1.1: Materia y energía
( \newcommand{\kernel}{\mathrm{null}\,}\)
¿Cuál es el problema?
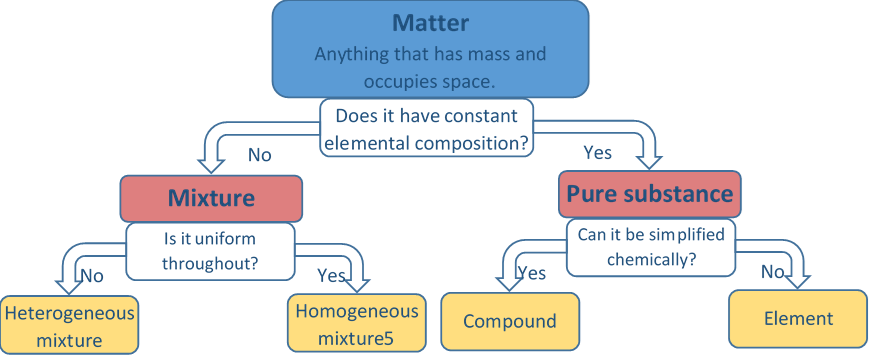
El asunto es cualquier cosa que tenga masa y ocupe espacio.
La materia es un material natural que conforma el universo. La materia está compuesta por diminutas partículas llamadas átomos que se mantienen unidas por fuerzas llamadas enlaces. La materia se clasifica como materia pura si tiene una composición constante y una no variable del tipo de átomos. La materia pur es un elemento o un compuesto.
Elemento
Un elemento es una materia pura que se compone de un solo tipo de átomo
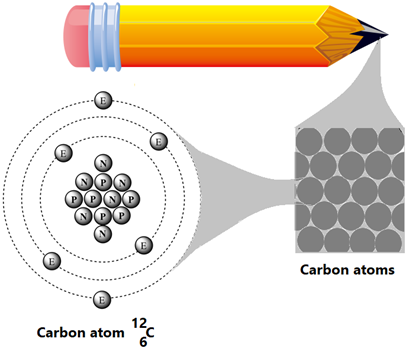
Por ejemplo, el carbono mostrado en la Fig. 1.1.1 es un elemento. Los elementos no pueden convertirse en una materia más simple por métodos físicos o químicos. Hay alrededor de un centenar de elementos diferentes conocidos en este momento. Por ejemplo, hidrógeno, oxígeno, carbono, nitrógeno, sodio, cloro, hierro, cobalto, oro y plata son algunos elementos.
Símbolo de un elemento
Los elementos están representados por símbolos, el primer alfabeto de su nombre inglés o no inglés, escritos en mayúsculas. Por ejemplo, C para carbono, O para oxígeno y H para hidrógeno. Por lo general, también se elige otro alfabeto del nombre del elemento y se escribe como letra pequeña, por ejemplo, He para helio, Co para cobalto. Algunos símbolos de elementos se derivan de nombres no ingleses, por ejemplo, Fe para hierro es de su nombre latino Ferrum, y Au para oro es de su nombre latino Aurum.
Dos letras mayúsculas consecutivas no representan un elemento; pueden ser dos elementos diferentes combinados.
El CO no es un símbolo de un elemento; es una materia pura que es una combinación de carbono y oxígeno, respectivamente, unidos entre sí en una relación atómica 1:1.
Molécula
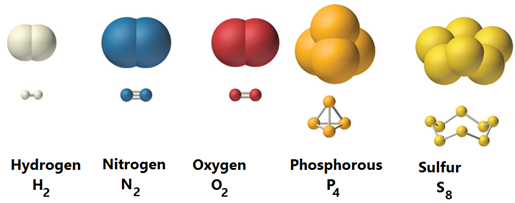
Una molécula es un grupo de dos o más átomos unidos por fuerzas llamadas enlaces químicos. La molécula es la partícula de materia más pequeña que puede existir libremente. Un solo átomo de algunos elementos es capaz de existir libremente, y también se le considera una molécula. Por ejemplo, He, O 2, P 4 y S 8 son ejemplos de elementos que tienen moléculas compuestas por uno, dos, cuatro y ocho átomos del mismo elemento, respectivamente, como se ilustra en la Fig. 1.1.2. Aunque los elementos metálicos existen como una gran cantidad de átomos unidos entre sí por un tipo especial de enlace llamado enlaces metálicos, su símbolo es el de un solo átomo, por ejemplo, Fe para hierro y Au para oro.
Compuesto
Un compuesto es una materia pura compuesta por átomos de dos o más elementos diferentes en una relación de número entero constante que se mantienen unidos por enlaces químicos.
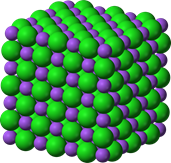
El símbolo de un compuesto es una combinación de sus elementos constituyentes con un subíndice a la derecha del símbolo del elemento que representa la relación numérica completa de los átomos del elemento en el compuesto. Por ejemplo, H 2 O simboliza un compuesto llamado agua compuesto por átomos de hidrógeno (H) y oxígeno (O) en una relación 2:1. Del mismo modo, el NaCl es un símbolo de un compuesto de sal de mesa compuesto por átomos de sodio (Na) y cloro (Cl) en una relación 1:1. Si el símbolo de un compuesto también representa una molécula del compuesto, se llama fórmula molecular. Por ejemplo, H 2 O es una fórmula molecular de agua. Por otro lado, la sal de mesa es otra clase de compuesto compuesto por un vasto número de átomos de sus elementos constituyentes dispuestos en una disposición específica en el espacio 3D denominada red cristalina, como se ilustra en la Fig. 1.1.3. Cuando el símbolo compuesto no representa una molécula, solo representa la relación simple de número entero de los elementos constituyentes; se llama fórmula química del compuesto. Por ejemplo, el NaCl es una fórmula química de un compuesto llamado sal de mesa.

Un compuesto químico siempre contiene el número de átomos de sus elementos componentes en una proporción fija, o los compuestos se forman por relaciones de masa definidas de elementos reactivos.
La materia pura, es decir, elementos o compuestos, tiene una proporción fija de átomos de elemento/s independiente de la fuente o método de su preparación, también se llama químico o sustancia. Los átomos en un compuesto se mantienen unidos por fuerzas atractivas llamadas enlaces químicos. Los elementos constituyentes de un compuesto pueden separarse solo rompiendo enlaces químicos y haciendo nuevos enlaces químicos, lo que es una reacción química.
Mezcla
Dos o más sustancias puras mezcladas de tal manera que la relación de átomos de los elementos constitutivos es variable se denomina mezcla.
Por ejemplo, la sal de mesa se puede mezclar con agua, pero la proporción de sal (NaCl) a agua (H 2 O) se puede variar para dar agua menos salada o más salada en una mezcla. Una mezcla en la que los componentes se mezclan a fondo, y la composición es constante a lo largo de una muestra dada es una mezcla homogénea o una solución. Por ejemplo, la sal de mesa disuelta en agua es un ejemplo de una mezcla homogénea o una solución. Otros ejemplos de mezcla homogénea incluyen azúcar disuelto en agua; el aire, que es una mezcla de nitrógeno, oxígeno, dióxido de carbono y otros gases; y aleaciones metálicas como latón, una mezcla de metales de cobre y zinc, etc.


Si los componentes de la mezcla no se mezclan a fondo y la composición varía dentro de diferentes regiones de una muestra dada, se trata de una mezcla heterogénea. Por ejemplo, el polvo de azufre (S) mezclado con relleno de hierro (Fe) es una mezcla heterogénea que se muestra en la Fig. 1.1.4. Otros ejemplos de mezclas heterogéneas incluyen humo que es una mezcla de partículas de aire y carbono; smog que es una mezcla de gotas de agua líquida suspendidas en el aire; y jugo de naranja que es una mezcla de azúcar, agua, partículas de fibra, etc. La Fig. 1.1.5 ilustra la clasificación de la materia descrita arriba.
Estados de la materia
La materia existe en uno de los cuatro estados o fases físicas, es decir, sólido (s), líquido (l), gas (g) o plasma. La Fig. 1.1.6 ilustra los cuatro estados de la materia a nivel molecular y la Fig. 1.1.7 muestra ejemplos de los cuatro estados de la materia.


Estado sólido
En estado sólido , las partículas, es decir, átomos o moléculas, están muy cerca entre sí y sostenidas fuertemente por fuerzas intermoleculares. Las partículas pueden vibrar alrededor de sus posiciones medias, pero no pueden deslizarse unas junto a otras. La expansión y contracción en estado sólido es insignificante. El sólido tiene una forma fija y un volumen fijo.
Estado líquido
En estado líquido, las partículas están lo suficientemente cerca como para experimentar fuertes interacciones intermoleculares que generalmente no permiten que las partículas crucen el límite líquido, pero las partículas pueden moverse dentro del líquido. En consecuencia, las partículas en un líquido pueden fluir y adquirir la forma del recipiente pero tienen un volumen fijo. La expansión y contracción son insignificantes en el estado líquido.
Estado del gas
En el estado gaseoso, las partículas están muy separadas. Las interacciones intermoleculares son despreciables en la fase gaseosa debido a las grandes distancias entre las partículas. Las moléculas de gas se mueven en líneas rectas en direcciones aleatorias hasta que chocan con otras moléculas o con las paredes del contenedor. Las colisiones son elásticas; es decir, las moléculas rebotan como bolas elásticas, y se conserva la energía cinética total del sistema. Si se exponen al espacio, las partículas siguen moviéndose hacia el espacio. En otras palabras, las partículas en un gas pueden fluir, adquirir la forma del contenedor y expandirse o contraerse para llenar el espacio disponible. Los gases no tienen una forma fija y no tienen un volumen fijo.
Estado de plasma
En el estado plasmático, las partículas están muy separadas como gases, y una porción de la carga negativa de las partículas, es decir, los electrones, se separan de la poción de carga positiva, es decir, el núcleo. Es decir, los átomos en el estado plasmático están ionizados. El estado plasmático no es común en la tierra, pero es el estado de materia más común del universo. Por ejemplo, la materia en el sol y las estrellas está en estado plasmático. Ejemplos del estado de plasma en la tierra incluyen la materia en los relámpagos y chispas eléctricas.
Qué es la energía
La energía es una propiedad cuantitativa transferida a un objeto y reconocible en la forma de realizar un trabajo o como calor o luz. En palabras simples: la energía es la capacidad de hacer el trabajo.
Lo que comúnmente encontramos aparte de la materia es la energía. Existen dos tipos básicos de energías, es decir, la energía cinética de los objetos en movimiento y la energía potencial almacenada por la posición de un objeto en un campo de fuerza.
Energía cinética
La energía de los objetos en movimiento es la energía cinética. La forma matemática de la energía cinética (KE) esKE=12mv2, donde m es la masa y v es la velocidad del objeto en movimiento. Ejemplos de energía cinética incluyen la energía de todos los objetos en movimiento que vemos alrededor, como vehículos en movimiento o una turbina en movimiento que genera electricidad. La energía térmica es también la energía cinética de los átomos y moléculas en una materia.
Energía potencial
La energía potencial se debe a la posición de un objeto en un campo de fuerza. Ejemplos de campos de fuerza responsables de la energía potencial incluyen fuerzas eléctricas, magnéticas, gravitacionales y elásticas. Ejemplos de energías potenciales son la energía eléctrica y la energía gravitacional. La luz es energía potencial debido a los campos eléctricos y magnéticos en movimiento. La energía química es energía potencial almacenada en enlaces químicos en energía potencial electrostática.
La energía potencial de gravitación es la energía debida a la posición o altura relativa a la tierra. La tierra atrae a otros objetos con una fuerzaF=mg, donde F es la fuerza, m es la masa del objeto y g es la aceleración debida a la gravedad. Cuando un objeto cae, la energía potencial cambia a varias formas de energía, incluida la energía cinética, el trabajo contra la fricción del aire, el sonido y el trabajo realizado en deformaciones cuando golpea el suelo.
La energía potencial química es la energía debida a los enlaces químicos que mantienen los átomos unidos en una molécula o compuesto a través de fuerzas eléctricas entre los electrones de carga negativa y los núcleos de carga positiva. La formación de enlaces siempre libera energía y la ruptura del enlace absorbe la misma energía. Cada enlace tiene diferente energía de enlace. En las reacciones químicas, algunos enlaces se rompen y se forman algunos enlaces.
También es posible una combinación de energía cinética y potencial, por ejemplo, en ondas mecánicas. Una onda sonora es una onda mecánica que combina la energía cinética y potencial —cinética porque las partículas se mueven y el potencial debido a la elasticidad del material en el que se propaga la deformación (sonido).
Reacciones exotérmicas y endotérmicas

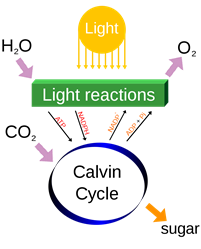
El equilibrio entre la energía necesaria para romper los enlaces y la energía liberada por la formación de nuevos enlaces determina si la reacción química libera energía o absorbe energía. Las reacciones químicas que liberan energía se denominan reacciones exotérmicas. Por ejemplo, la combustión de gas metano en quemadores de cocina libera energía. Una reacción que absorbe energía se llama reacción endotérmica. Por ejemplo, la fotosíntesis convierte el dióxido de carbono y el agua en glucosa al absorber la luz solar, como se ilustra en la Fig. 1.1.8.
Ley de conservación de la energía

La ley de conservación de energía establece que la energía puede transformarse de una forma a otra, pero la energía total de un sistema aislado sigue siendo la misma.
La energía puede transformarse de una forma a otra, ya sea a través del trabajo o del calor. Un péndulo oscilante es un ejemplo de energía potencial cinética y gravitacional que se transforma periódicamente entre sí a través del trabajo. La energía de radiación en la luz solar se transfiere a energía química durante la fotosíntesis, luego a calentar y trabajar durante el metabolismo de la glucosa, pero la energía total sigue siendo la misma, como se ilustra en la Fig. 1.1.9.


