3.8: Polaridad de moléculas
- Page ID
- 77228
La polaridad de un átomo
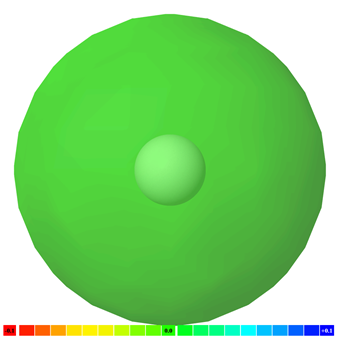
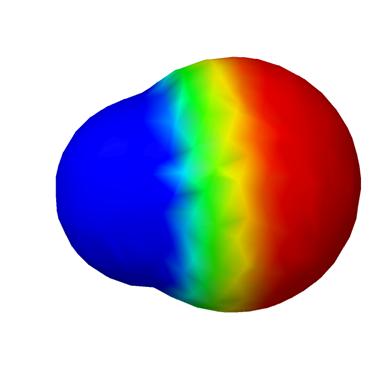
La carga negativa de los electrones equilibra la carga positiva de los protones en un átomo. Los electrones distribuidos simétricamente alrededor del núcleo no dejan final negativo ni positivo. Los átomos son no polares. La Fig. 3.8.1 ilustra la polaridad de un átomo de hidrógeno con códigos de color.
La polaridad de un enlace covalente
Cuando los átomos de un elemento se combinan para formar un enlace covalente, por ejemplo, H-H y F-F, las cargas positiva y negativa siguen siendo simétricas, y el enlace es no polar, es decir, ningún extremo negativo separado de un extremo positivo. Sin embargo, cuando los átomos de diferentes elementos se combinan para formar un enlace covalente, el átomo más electronegativo atrae al par de electrones de enlace hacia sí mismo más fuerte que el otro átomo. La separación de cargas positivas y negativas ocurre a medida que los electrones se desplazan más hacia el átomo electronegativo. El enlace se vuelve polar con un extremo parcialmente positivo (δ+) en el átomo electropositivo y un extremo parcialmente negativo (δ-) en el átomo electronegativo. Por ejemplo, el flúor es más electronegativo que el hidrógeno. En consecuencia, el flúor tira del par de electrones de enlace hacia sí mismo en la molécula H-F, creando una carga negativa parcial (δ-) en el flúor y una carga positiva parcial (δ+) en hidrógeno. El enlace H-F es polar. La Fig. 3.8.2 ilustra la polaridad en H-F con códigos de color.
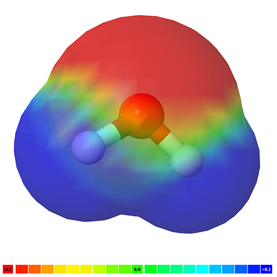
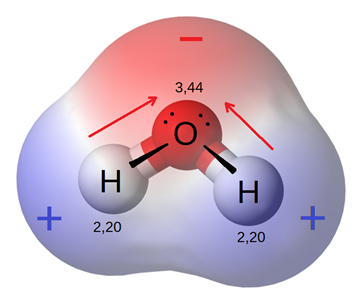
La polaridad del enlace es un vector que tiene una magnitud y dirección y puede ser representado por una flecha, al igual que otros vectores, como se muestra en la Fig. 3.8.3 para el caso de una molécula de agua.
Un enlace se categoriza como un enlace covalente no polar, covalente polar o un enlace iónico basado en la siguiente convención: covalente no polar si la diferencia electronegativa del átomo unido es menor de 0.5, un covalente polar si la diferencia de electronegatividad está entre 0.5 y 1.9, y un iónico si el la diferencia de electronegatividad es superior a 1.9.
La polaridad de una molécula
Las moléculas se clasifican en las siguientes categorías concernientes a la polaridad molecular.
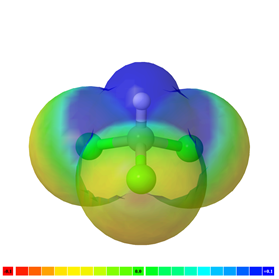
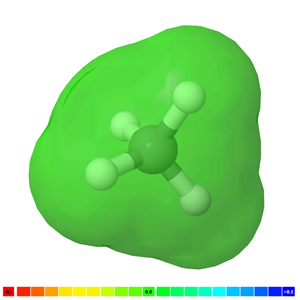
La molécula es no polar si no hay un enlace polar en ella, por ejemplo, H-H, F-F y CH 4 son moléculas no polares. La Fig. 3.8.4 ilustra moléculas de CH 4 con nubes de electrones de color verde que representan una molécula no polar.
Si solo hay un enlace polar en una molécula, entonces la molécula es polar, por ejemplo, la molécula H-F mostrada en la Fig. 3.8.2.
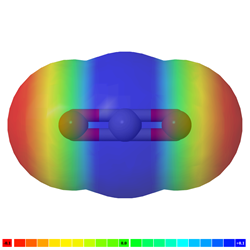
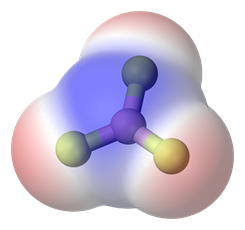
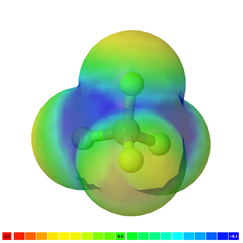
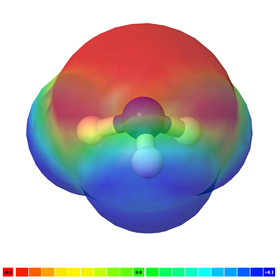
Si hay más de un enlace polar en una molécula, la molécula puede ser polar o puede ser no polar, dependiendo de la simetría de la molécula: a) El vector de polaridad de los enlaces individuales se cancela en moléculas simétricas haciendo que la molécula sea no polar. Por ejemplo, las moléculas simétricas, como CO 2, BF 3 y CCl 4, son no polares, aunque cada enlace en ellas es polar. La Fig. 3.8.5 ilustra las moléculas simétricas que tienen enlaces polares, pero la polaridad de los enlaces se cancela entre sí, haciendo que la molécula no sea polara. b) Si una molécula tiene enlaces polares y no es simétrica, los vectores de polaridad no se cancelan, y la molécula es polar. Los ejemplos de moléculas polares incluyen CHCl 3, NH 3 y H 2 O, como se ilustra en la Fig. 3.8.6.