3.9: Fuerzas intramoleculares y fuerzas intermoleculares
( \newcommand{\kernel}{\mathrm{null}\,}\)
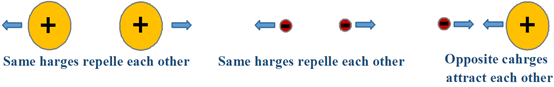
Hay interacción electrostática entre cargas o cargas parciales, es decir, las mismas cargas se atraen entre sí, y las cargas opuestas se repelen entre sí, como se ilustra en la Fig. 3.9.1.Existen dos tipos de fuerzas electrostáticas en compuestos o moléculas, fuerzas intramoleculares que existen entre los átomos unidos de un compuesto o una molécula, y las fuerzas intermoleculares que existen entre las moléculas como se describe a continuación.
Fuerzas intramoleculares
Las fuerzas intramoleculares son los enlaces químicos que mantienen los átomos juntos en las moléculas. Los tres tipos principales de enlaces químicos son el enlace metálico, el enlace iónico y el enlace covalente.
Fijación metálica
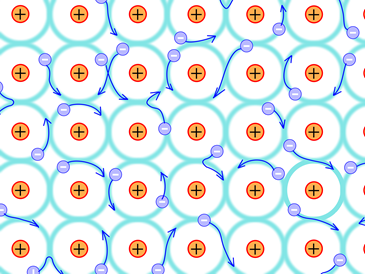
Los metales existen como una colección de muchos átomos como +iones dispuestos en una disposición 3D bien definida llamada red cristalina con algunos de los electrones más externos vagando por toda la pieza del metal, formando un mar de electrones alrededor de los átomos metálicos, como se ilustra en la Fig. 3.9.2. La atracción entre los iones +y el mar de electrones que se mueven libremente es el enlace metálico que mantiene los átomos unidos en una pieza de metal. El enlace metálico suele ser el tipo de enlace químico más fuerte.
Enlace iónico
Cuando la diferencia de electronegatividad entre los átomos unidos es grande, es decir, más de 1.9 en la mayoría de los casos, los electrones de enlace se transfieren completamente de un átomo más electropositivo a un átomo más electronegativo creando un catión y un anión, respectivamente. Existe la interacción electrostática entre catión y anión, es decir, las mismas cargas se atraen entre sí, y las cargas opuestas se repelen entre sí, como se ilustra en la Fig. 3.9.1. Los cationes y aniones se orientan en una red cristalina 3D de tal manera que las interacciones atractivas maximizan y las interacciones repulsivas minimizan, como se ilustra en la Fig. 3.9.3. Los enlaces iónicos suelen ser más débiles que los enlaces metálicos pero más fuertes allí los otros tipos de enlaces.

Enlace covalente
Cuando la diferencia de electronegatividad entre los átomos enlazados es moderada a cero, es decir, usualmente menor de 1.9, los electrones de enlace se comparten entre los átomos enlazados, como se ilustra en la Fig. 3.9.4. La fuerza de atracción entre los electrones de unión y los núcleos es el enlace covalente que mantiene los átomos juntos en las moléculas. El enlace covalente suele ser más débil que el metálico y los enlaces iónicos, pero mucho más fuerte que las fuerzas intermoleculares.

Criterios para predecir el tipo de enlace químico
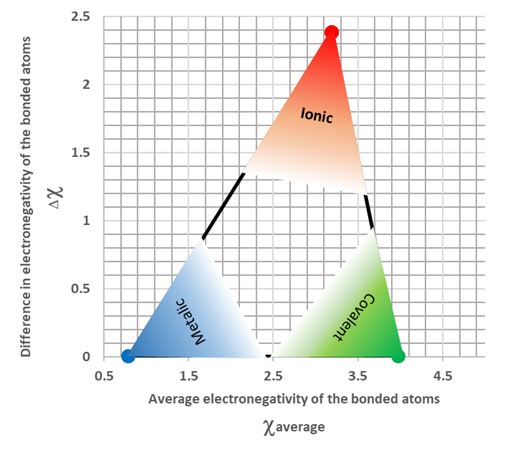
Los metales tienden a tener menor electronegatividad y los no metales tienen mayor electronegatividad. Cuando la diferencia de electronegatividad entre los átomos enlazados es grande, generalmente más de 1.9, el enlace es iónico. Generalmente, un enlace entre un metal y un no metal es iónico. Cuando la diferencia de electronegatividad es baja, generalmente menor de 1.9, el enlace es metálico o covalente. Los no metales tienden a formar un enlace covalente entre sí. Los no metales también tienen mayores electronegatividades. Entonces, cuando la electronegatividad promedio del átomo unido es alta y la diferencia de electronegatividad entre ellos es baja, tienden a hacer un enlace covalente. Los metales tienden a hacer el enlace metálico entre sí. Los metales también tienden a tener valores de electronegatividad más bajos. Entonces, cuando la electronegatividad promedio del átomo unido es baja y la diferencia de electronegatividad entre ellos también es baja, tienden a hacer un enlace metálico. La Fig. 3.9.5 ilustra los criterios para predecir el tipo de enlace químico basado en la diferencia de electronegatividad. Tenga en cuenta que no existe un límite agudo entre los enlaces metálicos, iónicos y covalentes basados en las diferencias de electronegatividad o los valores promedio de electronegatividad.
Fuerzas intermoleculares
Las fuerzas intermoleculares son las interacciones electrostáticas entre las moléculas. Las fuerzas intermoleculares suelen ser mucho más débiles que las fuerzas intramoleculares, pero aún así, juegan un papel importante en la determinación de las propiedades de los compuestos. Las principales fuerzas intermoleculares incluyen la interacción dipolo-dipolo, los enlaces de hidrógeno y las fuerzas de dispersión de Londres.
Interacciones dipolo-dipolo
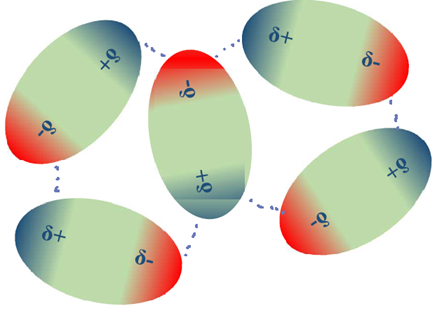
Las moléculas polares tienen dipolos permanentes, un extremo de la molécula es parcial positivo (δ+) y el otro es parcial negativo (δ-). Las moléculas polares tienen interacciones electrostáticas entre sí a través de sus extremos δ+ y δ- llamados interacciones dipolo-dipolo, aunque estas interacciones son más débiles que los enlaces iónicos. Las moléculas polares se orientan de manera que maximizan las fuerzas de atracción entre las cargas opuestas y minimizan las fuerzas repulsivas entre las mismas cargas, como se ilustra en la Fig. 3.9.6.
Enlaces de hidrógeno
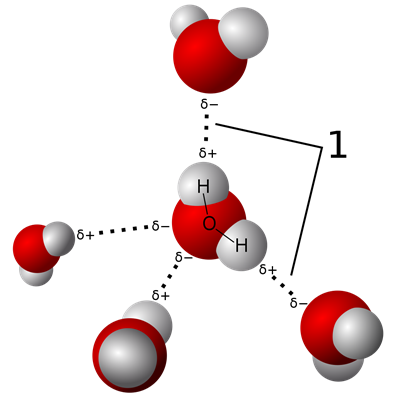
El enlace de hidrógeno es una interacción dipolo-dipolo cuando el dipolo es un enlace de hidrógeno a O, N o F, por ejemplo, en moléculas de agua como se ilustra en la Fig. 3.9.7. Aunque el enlace de hidrógeno es una interacción dipolo-dipolo, se distingue de las interacciones dipolo-dipolo habituales debido a las siguientes características especiales.
- La diferencia de electronegatividad entre H y O, N o F suele ser mayor que otros enlaces polares.
- La densidad de carga en hidrógeno es mayor que los extremos δ+ del resto de los dipolos debido al menor tamaño del hidrógeno.
- El Hidrógeno δ+ puede penetrar en espacios menos accesibles para interactuar con el δ- O, N o F de la otra molécula debido a su pequeño tamaño.
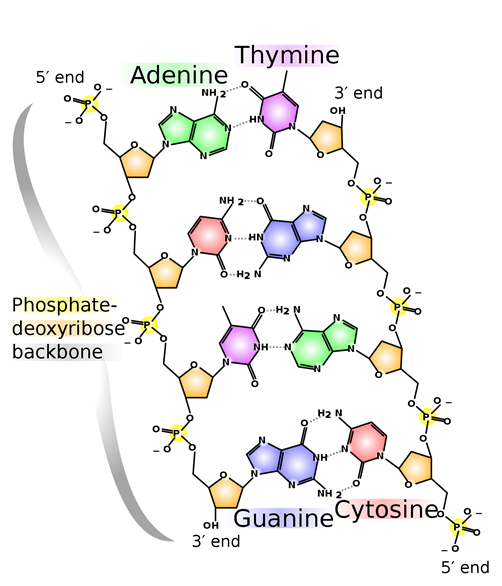
Un enlace de hidrógeno suele ser más fuerte que las interacciones dipolo-dipolo habituales. El enlace de hidrógeno es la interacción intermolecular más común y esencial en biomoléculas. Por ejemplo, dos cadenas de moléculas de ADN se mantienen juntas a través de enlaces de hidrógeno, como se ilustra en la Fig. 3.9.8. Las proteínas también adquieren características estructurales necesarias para sus funciones principalmente a través de enlaces de hidrógeno.
Fuerzas de dispersión de Londres
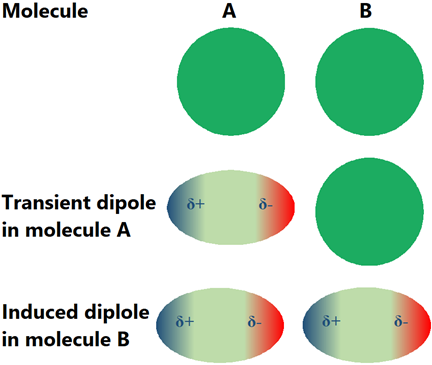
Puede parecer que las moléculas no polares no deben tener interacciones intermoleculares. Prácticamente, existen interacciones intermoleculares llamadas fuerzas de dispersión de Londres, en todas las moléculas, incluyendo las moléculas no polares. La nube de electrones alrededor de los átomos no es siempre simétrica alrededor de los núcleos. Se mueve temporalmente hacia un lado u otro, generando un dipolo transitorio. El dipolo transitorio induce un dipolo en el vecino. Una interacción transitoria dipolo inducida por dipolo, llamada fuerza de dispersión de Londres o fuerza de Wander Wall, se establece entre las moléculas vecinas como se ilustra en la Fig. 3.9.9. Aunque las fuerzas de dispersión de Londres son transitorias, siguen reapareciendo distribuidas aleatoriamente en el espacio y el tiempo. Las fuerzas de dispersión de Londres no son exclusivas de las moléculas no polares, están presentes en todo tipo de moléculas, pero estas son las únicas fuerzas intramoleculares presentes en las moléculas no polares.