6.2: Ácidos y bases Brønsted—Lowry
- Page ID
- 77262
Algunas bases no tienen iones hidróxido en su fórmula, sin embargo actúan como bases y neutralizan los ácidos. Por ejemplo, el amoníaco (NH 3) y el carbonato de calcio (CaCo 3) no contienen iones hidróxido, sino que neutralizan los ácidos. Además, la definición de Arrhenius limita las reacciones ácido-base en el medio agua. Las reacciones ácido-base pueden tener lugar en otros medios también, por ejemplo, HCl —un ácido, y NH 3 —una base pueden reaccionar y neutralizarse entre sí en la fase gaseosa también. El Brønsted—Lowry limitó la definición de ácidos y bases al incluir las bases mencionadas anteriormente y también al incluir reacciones ácido-base en un medio no acuoso.
Definición de Brønsted—Lowry de ácidos y bases
La definición de Brønsted—Lowry establece que:
- Un ácido es un donante de protones, y
- Una base es un aceptor de protones.
o ejemplo, el HCl es un ácido porque dona un protón al disolvente del agua.
\[\mathrm{HCl}(\mathrm{g})+\mathrm{H}_{2} \mathrm{O}(\mathrm{l}) \rightarrow \mathrm{Cl}^{-}(\mathrm{aq})+\mathrm{H}_{3} \mathrm{O}^{+}(\mathrm{aq})\nonumber\]
El agua es una base en la reacción anterior porque acepta un protón del ácido. En una reacción entre HCl y NH 3:
\[\mathrm{HCl}(\mathrm{g})+\mathrm{NH}_{3}(\mathrm{~g}) \rightarrow \mathrm{NH}_{4} \mathrm{Cl}(\mathrm{s})\nonumber\]
El HCl es un ácido porque dona su protón al NH 3, y el NH 3 es una base porque acepta un protón, como se muestra en la Fig. 6.2.1.

Los ácidos de Brønsted—Lowry tienen protones ionizables que donan a las bases. Por lo tanto, Brønsted—el ácido de Lowry generalmente se escribe como HA, donde H + es el protón donable, y A - es el anión del ácido. Ejemplos de ácidos son HCl, H 2 SO 4, HNO 3 y CH 3 COOH. Tenga en cuenta que el ácido acético tiene solo un protón ácido que está unido al átomo de O en el grupo ácido carboxílico (—COOH). El resto de los protones unidos a los átomos de carbono no son ácidos. Todos los ácidos orgánicos tienen un grupo ácido carboxílico (—COOH). El ácido de Brønsted—Lowry puede tener carga neta +ve, sin cargo o carga neta —ve en él. Por ejemplo, H 3 O +, HCl y HSO 4 - son todos ácidos porque pueden donar un protón a una base.
Ácidos mono-, di- y tri-próticos
Los ácidos que tienen solo un protón ácido son mono- próticos, por ejemplo, H Cl, H NO 3, CH 3 COO H, son ácidos mono- próticos donde el protón ácido se muestra en negrita. Algunos ácidos tienen dos protones ácidos —son di- próticos, por ejemplo, H 2 SO 4 y H 2 CO 3 son di- próticos. Los ácidos con tres protones ácidos son tri- próticos, por ejemplo, H 3 PO 3 es un ácido tri- prótico. Por ejemplo, el ácido fosfórico (H 3 PO 4) puede disociarse y donar tres protones, como se muestra en las reacciones químicas a continuación:
\ begin {alineado}
&\ mathrm {H} _ {3}\ mathrm {PO} _ {4} +\ mathrm {H} _ {2}\ mathrm {O}\ mathrm {O}\ rightleftharpoons\ mathrm {H} _ {3}\ mathrm {O} ^ {+} +\ mathrm {H} _ {2}\ mathrm {PO} _ {4} {^} {-}\\
&\ mathrm {H} _ {2}\ mathrm {PO} _ {4} {} {} ^ {-} +\ mathrm {H} _ {2}\ mathrm {O}\ rightleftharpoons\ mathrm {H} _ {3}\ mathrm {O} ^ {+ } +\ mathrm {HPO} _ {4} {} ^ {2-}\\
&\ mathrm {HPO} _ {4} {} ^ {2-} +\ mathrm {H} _ {2}\ mathrm {O}\ rightleftharpoons\ mathrm {H} _ {3}\ mathrm {O} ^ {+} +\ mathrm {PO} _ {4} {} ^ {3-}
\ final {alineado}
La base acepta protones al hacer un vínculo con él. El enlace es un par de electrones unidos. Dado que el protón es un átomo de hidrógeno sin electrón, ambos electrones en el enlace provienen de la base. La base debe tener un par solitario de electrones sobre ella. La base generalmente se representa como para enfatizar un par solitario de electrones en ella que se muestra como un par de puntos. Por ejemplo, el amoníaco, el agua y el ion hidróxido (
para enfatizar un par solitario de electrones en ella que se muestra como un par de puntos. Por ejemplo, el amoníaco, el agua y el ion hidróxido (
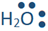 , y
, y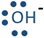 ) son las bases de Brønsted—Lowry, porque cada una de ellas tiene un átomo con pares solitarios o pares solitarios de electrones sobre ellas.
) son las bases de Brønsted—Lowry, porque cada una de ellas tiene un átomo con pares solitarios o pares solitarios de electrones sobre ellas.
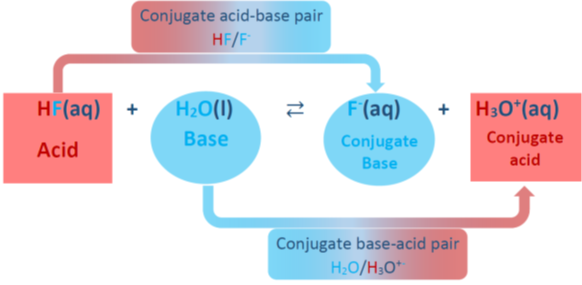
Pares ácido-base conjugados
Las reacciones ácido-base descritas anteriormente son reacciones unidireccionales, es decir, los reactivos van a productos casi al 100%. Sin embargo, la mayoría de las reacciones ácido-base son de dos maneras, es decir, los reactivos forman los productos y los productos reaccionan entre sí y vuelven a formar los reactivos. Las flechas dobles entre los reactivos y los productos representan las reacciones de dos vías. Por ejemplo, el ácido fluorhídrico (HF) es un electrolito débil; se disocia parcialmente en agua para formar F - y H 3 O +, y los productos reaccionan para reformar los reactivos, como se muestra en la Fig. 6.2.2. En la reacción inversa, H 3 O + está actuando como un ácido, y F - está actuando como base. El ácido y la base en los productos se denominan ácido conjugado y base conjugada, respectivamente. El ácido HF se convierte en base conjugada F - después de la eliminación de un protón, y la base H 2 O se convierte en ácido conjugado H 3 O + después de aceptar un protón.
El par ácido base conjugado está relacionado con la pérdida y ganancia de H +. Por ejemplo, HF/F - es un par ácido-base conjugado, y H 3 O + /H 2 O es también un par ácido-base conjugado.
Es decir, eliminar el protón ácido de un ácido para obtener su base conjugada y agregar un protón a una base para obtener su ácido conjugado.
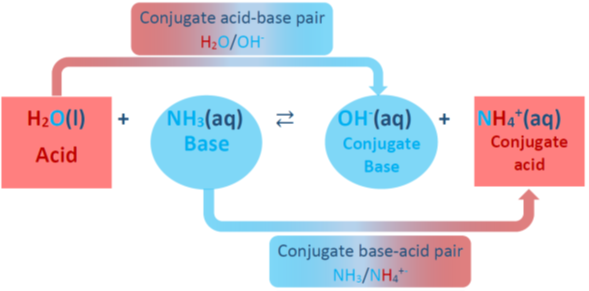
Otro ejemplo es el amoníaco NH 3 que se disuelve en agua y acepta un protón para formar su conjugado ácido NH 4 +, como se muestra en la Fig. 6.2.3. El agua H 2 O actúa como un ácido donando un protón y formando su base conjugada OH -. Los dos pares ácido-base conjugados en esta reacción son NH 4 + /NH 3 y H 2 O/OH - que están relacionados por pérdida y ganancia o un H +.
Identificar los pares ácido-base conjugados en la siguiente reacción?
\[\mathrm{H}_{3} \mathrm{PO}_{4}(\mathrm{aq})+\mathrm{NH}_{3}(\mathrm{aq}) \rightleftarrows \mathrm{H}_{2} \mathrm{PO}_{4}^{-}+\mathrm{NH}_{4}^{+}\nonumber\]
Solución
- Identificar la sustancia que ha donado un protón en los reactivos, es un ácido.
- Retirar un protón del ácido para formar su base conjugada: H 3 PO 4 /H 2 PO 4 -.
- Identificar la sustancia que ha aceptado un protón en los reactivos, es una base.
- Añadir un protón a la base para formar su ácido conjugado: NH 3 /NH 4 +.
Nótese que la pérdida de un protón de un ácido forma su base conjugada con la carga disminuida en uno, por ejemplo, H 3 PO 4/H 2 PO 4 -, HSO 4 - /SO 4 2 -, y NH 4 +/ NH 3. De igual manera, la ganancia de un protón por una base forma su ácido conjugado con la carga incrementada en uno, por ejemplo, HPO 4 2 - /H 2 PO 4 -, HCO 3 - /H 2 CO 3, y NH 3 /NH 4 +.
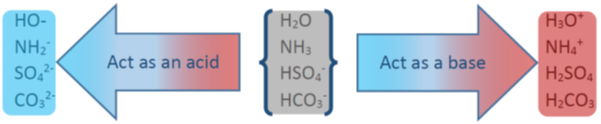
Sustancias anfóteras
El agua actúa como base en algunas reacciones, por ejemplo, con HF, y como ácido en algunas reacciones, por ejemplo, con NH 3.
Las sustancias como el agua que pueden actuar como ácido y también como base se denominan sustancias anfóteras.
Otros ejemplos de sustancias anfóteras incluyen HSO 4 -, HCO 3 - y NH 3, como se ilustra en la Fig. 6.2.4.