6.3: Fuerza de ácidos y bases
- Page ID
- 77270
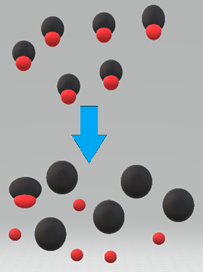
La fuerza del ácido HA es la medida en que el ácido se disocia en iones H + y A -, como se ilustra en la Fig. 6.3.1.
Ácidos fuertes
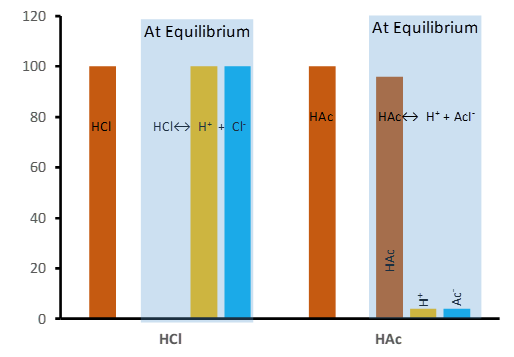
Los ácidos fuertes, como el HCl, casi el 100% se disocian en iones cuando se disuelven en agua.
\ begin {ecuación}
\ mathrm {HCl} (\ mathrm {g}) +\ mathrm {H} _ _ {2}\ mathrm {O} (\ mathrm {l})\ rightarrow\ mathrm {H} _ {3}\ mathrm {O} ^ {+} (\ mathrm {aq}) +\ mathrm {Cl} ^ {-} (\ mathrm {aq})\ nonumber\ end {ecuación}
Se utiliza una flecha para indicar que la reacción está casi 100% completa.
Los ácidos fuertes incluyen HClO 4, H 2 SO 4, HI, HBr, HCl y HNO 3
Ácidos débiles
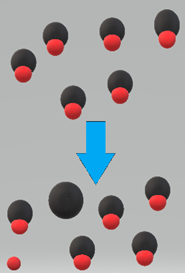
Los ácidos débiles se disuelven en agua pero se disocian parcialmente en iones.
Por ejemplo, el ácido acético (CH 3 COOH) es un ácido débil, el ácido acético 1 M se disuelve en agua, pero solo 0.4% de las moléculas disueltas se disocian en iones, el 99.6% restante permanece sin disociar, como se ilustra en la Fig. 6.3.2. y la ecuación del equilibrio de disociación a continuación.
\ begin {ecuación}
\ mathrm {CH} _ {3}\ mathrm {COOH} (\ mathrm {aq}) +\ mathrm {H} _ {2}\ mathrm {O} (\ mathrm {I})\ stackrel {\ rightarrow} {\ longleftarrow}\ mathrm {H} _ _ {3}\ mathrm {O} ^ {+} (\ mathrm {O} ^ {+} (\ mathrm {O} rm {aq}) +\ mathrm {CH} _ {3}\ mathrm {COO} ^ {-} (\ mathrm {aq})\ nonumber
\ end {ecuación}
Se utilizan dos flechas que apuntan en direcciones opuestas para la disociación de ácidos débiles para indicar que la reacción es un equilibrio, es decir, de dos vías.
A menudo las flechas no son iguales en tamaño -la flecha más larga apunta al par ácido-base que es más débil y está presente en una concentración mayor en equilibrio que su par conjugado.
Bases fuertes
Las bases fuertes casi %100 se disocian en iones cuando se disuelven en agua. Por ejemplo, el NaOH es una base fuerte, y se disocia casi el 100% en iones en el agua.
Las bases fuertes casi %100 se disocian en iones cuando se disuelven en agua. Por ejemplo, el NaOH es una base fuerte, y se disocia casi el 100% en iones en el agua.
\ begin {ecuación}
\ mathrm {NaOH} (\ mathrm {s})\ stackrel {\ text {Agua}} {\ longrightarrow}\ mathrm {Na} ^ {+} (\ mathrm {aq}) +\ mathrm {OH} ^ {-} (\ mathrm {aq})\ nonumber
\ end {ecuación}
Se utiliza una flecha para la disolución de bases fuertes para indicar que la reacción es casi completa.
Las bases fuertes incluyen hidróxidos de metales alcalinos, es decir, LiOH, NaOH, KOH, RbOH, CsOH e hidróxidos de metales alcalinotérreos pesados, es decir, Ca (OH) 2, Sr (OH) 2 y Ba (OH) 2.
Los tres últimos, es decir, los hidróxidos de metales pesados alcalinotérreos, tienen baja solubilidad en agua, pero la fracción disuelta existe como iones.
Bases débiles
Las bases débiles se disocian parcialmente en iones cuando se disuelven en agua.
Por ejemplo, el amoníaco es una base débil, solo 0.42% de las moléculas de amoníaco disueltas se disocian en iones amonio e iones hidróxido en agua a partir de una solución 1 M de amoníaco.
\ begin {ecuación}
\ mathrm {NH} _ {3} (\ mathrm {aq}) +\ mathrm {H} _ {2}\ mathrm {O} (\ mathrm {I})\ stackrel {\ rightarrow} {\ longleftarrow}\ mathrm {NH} _ {4} {} {} ^ {+} (\ mathrm {aq}) +\ mathrm {OH} ^ {-} (\ mathrm {aq})\ nonumber\
\ end {ecuación}
Las bases débiles en uso doméstico incluyen amoníaco (NH 3) en limpiadores de ventanas, NaClO en lejía, Na 2 CO 3 y Na 3 PO 4 en detergente para lavar ropa, NaHCO 3 en dientes pasados, Na 2 CO 3 en polvo de hornear, CaCo 3 para usar en céspedes, Mg (OH) 2 y Al (OH) 3 en antiácidos y laxantes.
Las bases débiles mencionadas anteriormente son todas compuestos iónicos excepto el amoníaco. Los compuestos iónicos son electrolitos fuertes, es decir, se disocian en iones casi al 100% al disolverse en agua. Parece contradecir el hecho de que estos compuestos iónicos son bases débiles. En realidad no contradice, debido a que las propiedades de base no se refieren a estos compuestos iónicos, las propiedades de base se refieren a las reacciones de sus aniones poliatómicos, es decir, ClO -, CO 3 2 -, y PO 4 3 - con agua, como que se muestran en las reacciones siguientes:
\ begin {ecuación}
\ begin {alineada}
&\ mathrm {ClO} ^ {-} +\ mathrm {H} _ {2}\ mathrm {O}\ stackrel {\ rightarrow} {\ longleftarrow}\ mathrm {HClO} +\ mathrm {OH} ^ {-}\\
&\ mathrm {CO} _ {3} ^ {2-} +2\ mathrm {H} _ {2}\ mathrm {O}\ stackrel {\ rightarrow} {\ longleftarrow}\ mathrm {H} _ _ {2}\ mathrm { CO} _ {3} +2\ mathrm {OH} ^ {-}\ text {, y}\\
&\ mathrm {PO} _ {4} {} ^ {3-} +3\ mathrm {H} _ {2}\ mathrm {O}\ stackrel {\ rightarrow} {\ longleftarrow}\ mathrm {H} _ _ {3}\ mathrm {PO} _ {4} +3\ mathrm {OH} ^ {-}
\ final {alineado}\ nonumber
\ final {ecuación}
Las reacciones anteriores son reacciones de equilibrio que se ven más favorecidas en los revers que en la dirección hacia adelante, produciendo un pequeño número de iones OH - en comparación con el anión en los lados reactivos. Los dos últimos ejemplos, es decir, Mg (OH) 2 y Al (OH) 2 se clasifican como bases débiles porque se consideran insolubles en agua. La solubilidad de Mg (OH) 2 es 0.00064 g/100 mL (25 °C), y la solubilidad de Al (OH) 3 es 0.0001 g/100 mL, los cuales están en el rango de compuestos iónicos insolubles.
La solubilidad y la fuerza de ácidos y bases son dos cosas diferentes. Una base fuerte puede ser menos soluble, y una base débil puede ser más soluble o viceversa, pero una base fuerte disuelta existe solo como iones, y una base débil disuelta existe tanto como moléculas como iones.
La fuerza relativa del par de bases ácido-conjugado
Una regla general es que cuanto más fuerte es el ácido, más débil es la base conjugada, y viceversa.
Las bases conjugadas de los ácidos fuertes tienen una fuerza base insignificante, y los ácidos conjugados de los bajos fuertes tienen una fuerza ácida insignificante. La Fig. 6.3.3. ilustra las fuerzas relativas de algunos ácidos y sus bases conjugadas.
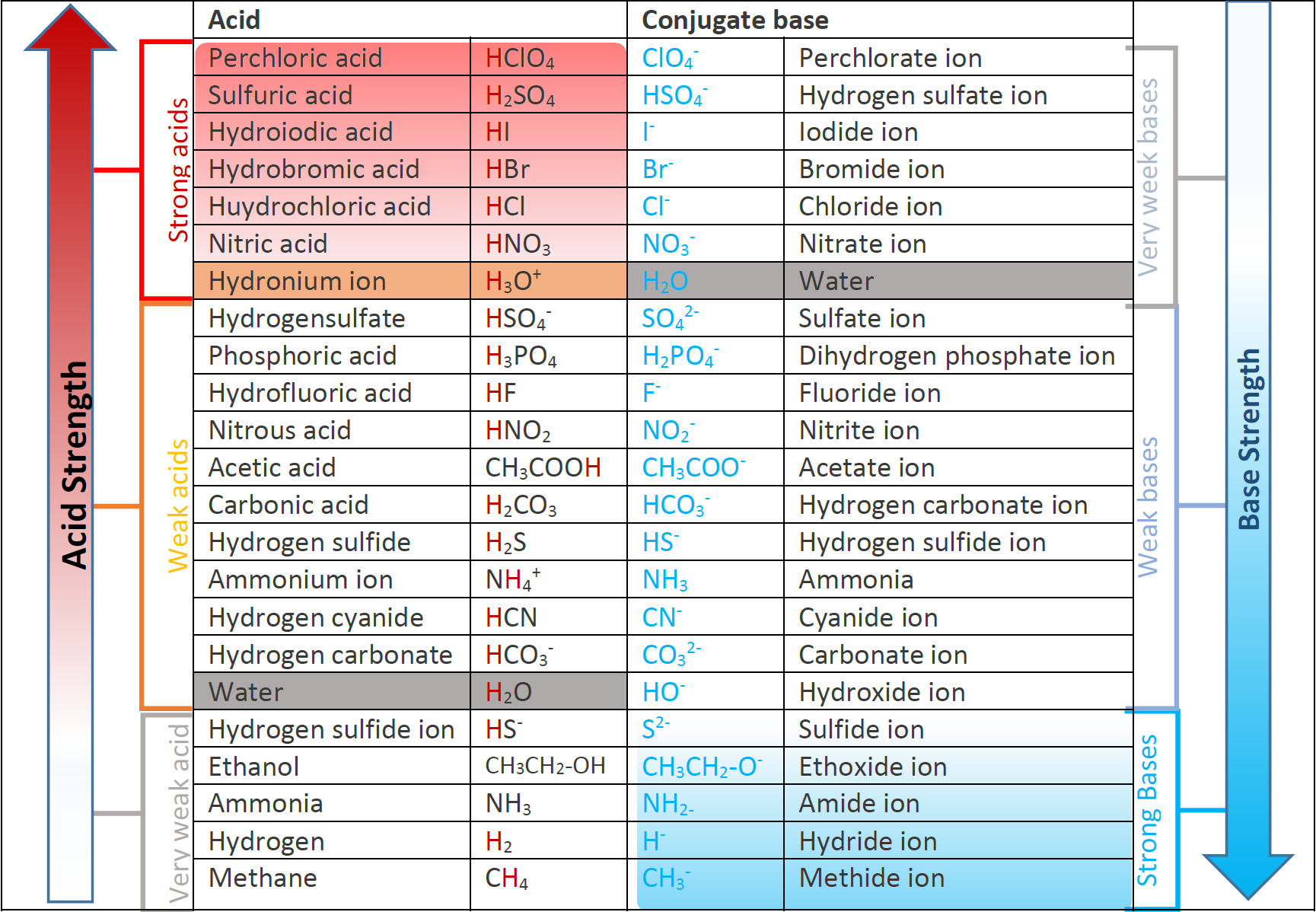
En cualquier reacción ácido-base de Brønsted-Lowry, la regla general es que un ácido más fuerte y una base más fuerte tienden a formar un ácido más débil y una base más débil.
Por ejemplo, una reacción de disociación entre HCl y H 2 O es casi 100% completa porque HCl es un ácido más fuerte que H 3 O + y H 2 O es una base más fuerte que Cl -:
\ begin {ecuación}
\ mathrm {HCl} +\ mathrm {H} _ {2}\ mathrm {O}\ rightarrow\ mathrm {H} _ {3}\ mathrm {O} ^ {+} +\ mathrm {Cl} ^ {-}\ nonumber
\ end {ecuación}
La disolución de ácido acético (CH 3 COOH) y amoníaco (NH 3) son reacciones de equilibrio porque todos los ácidos, bases y sus conjugados están en la categoría de ácidos débiles o bases débiles. Sin embargo, el ácido acético y el agua dominan sobre sus conjugados H 3 O + y CH 3 COO - en una relación 99. 6:0 .4 (en solución de ácido acético 1 M) debido a que el ácido conjugado H 3 O + es un ácido más fuerte que CH 3 COOH, y base conjugada CH 3 COO - es una base más fuerte que H 2 O.
\ begin {ecuación}
\ mathrm {CH} _ {3}\ mathrm {COOH} (\ mathrm {aq}) +\ mathrm {H} _ {2}\ mathrm {O} (\ mathrm {l})\ stackrel {\ rightarrow} {\ longleftarrow}\ mathrm {H} _ _ {3}\ mathrm {O} ^ {+} (\ mathrm {O} ^ {+} (\ mathrm {O} rm {aq}) +\ mathrm {CH} _ {3}\ mathrm {COO} ^ {-} (\ mathrm {aq})\ nonumber
\ end {ecuación}
La flecha más larga, en las flechas de equilibrio desequilibrado, apunta al par ácido-base en la reacción que existe en una mayor concentración en relación con sus conjugados.
De igual manera, el amoníaco (NH 3) y el agua (H 2 O) dominan sobre sus conjugados NH 4 + y OH - en una relación ~99. 6:0 .4 (solución de amoníaco 1M) debido a que el ácido conjugado NH 4 + es un ácido más fuerte que H 2 O y la base conjugada OH - es una base más fuerte que NH 3.
\ begin {ecuación}
\ izquierda. \ mathrm {NH} _ {3} (\ mathrm {aq}) +\ mathrm {H} _ {2}\ mathrm {O} (\ mathrm {I})\ derecha)\ stackrel {\ rightarrow} {\ longleftarrow}\ mathrm {NH} _ {4} ^ {+} (\ mathrm {aq}) +\ mathrm {OH} ^ {^ -} (\ mathrm {aq})\ nonumber
\ end {ecuación}


