7.3: La relación temperatura-volumen
- Page ID
- 77261
Considera un gas en un cilindro con un pistón en la Fig. 7.3.1. El aumento de la temperatura aumenta la energía cinética promedio (KE) de las moléculas de gas. La energía cinética (KE) es directamente proporcional a la velocidad de las moléculas, es decir\(KE=\frac{1}{2}mv^2\nonumber\), donde m es la masa y v es la velocidad. Entonces, el aumento de la temperatura aumenta la velocidad resultando en colisiones más frecuentes y más contundentes que resultan en un aumento de la presión del gas dentro de la cámara. El volumen de gas comienza a aumentar provocando que la presión disminuya hasta que la presión dentro de la cámara sea igual a la presión exterior. Es decir, al aumentar la temperatura se incrementa el volumen del gas si no se cambia la presión y la cantidad de gas.
Si dos parámetros relacionados aumentan o disminuyen juntos, son directamente proporcionales entre sí.
La ley de Charles establece que el volumen de una cantidad dada de gas es directamente proporcional a la temperatura en la escala Kelvin a presión constante.
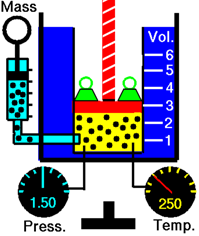
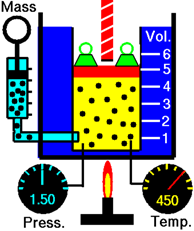
La Fig. 7.3.2 demuestra que el volumen de un gas disminuye cuando se enfría el gas.



Las formas matemáticas de la ley de Carlos son las siguientes.
\[V\propto{T}\nonumber\], o\[V=\mathrm{k}T\nonumber\], o\[\frac{V}{T}=\mathrm{k}\nonumber\]
, donde k es una constante, V es volumen y T es la temperatura (en escala kelvin) del gas. Dado que\(\frac{V}{T}\) es una constante, implica que
\[\frac{V_{1}}{T_{1}}=\frac{V_{2}}{T_{2}}=\mathrm{k}\nonumber\]
donde V 1 es el volumen inicial, T1 es la temperatura inicial en Kelvin, V 2 es el volumen final, y T 2 es la temperatura final en Kelvin, siempre que la cantidad de gas y presión no cambien. Tenga en cuenta que la escala kelvin se usa en la ley de Charles porque la escala kelvin no tiene números negativos, lo que significa que la curva lineal comienza desde el origen sin ninguna intercepción y. Si la temperatura dada no está en la escala Kelvin, primero convierta la temperatura a la escala Kelvin y luego use las leyes de gas para los cálculos.
Una muestra de CO 2 ocupa 3.23 L de volumen a 25.0 o C. Calcular el volumen del gas a 50.0 o C si la presión y la cantidad de gas no cambian?
Solución
Dado: T 1 = 25.0 o C + 273 = 298 K, T 2 = 50.0 o C + 273 = 320 K, V 1 = 3.23 L, V 2 =?
Fórmula:\(\frac{V_1}{T_2}=\frac{V_2}{T_2}\), reorganizar la fórmula para aislar la variable deseada:\(V_{2}=\frac{V_{1} T_{1}}{T_{2}}\)
Conecte los valores en la fórmula reordenada y calcule:\(V_{2}=\frac{3.23 \mathrm{~L} \times 3.20 \mathrm{~K}}{273 \mathrm{~K}}=3.79 \mathrm{~L}\)
La ley de Carlos explica la deriva del aire caliente hacia arriba en la atmósfera. A medida que el gas es desparasitado, su volumen aumenta y su densidad disminuye lo que hace que el gas se deslice hacia arriba. Un globo de aire caliente, mostrado en la Fig. 7.3.3 opera usando aire caliente.



