7.4: La relación presión-temperatura
- Page ID
- 77268
Considera un gas en un cilindro con un pistón en la Figura\(\PageIndex{1}\). El aumento de la temperatura aumenta la energía cinética promedio (KE) y la velocidad promedio de las moléculas de gas dando como resultado colisiones más frecuentes y más contundentes que resultan en una mayor presión de gas aplicada sobre el pistón o las paredes del contenedor de gas.
La ley de Gay-Lussac establece que la presión de un gas es directamente proporcional a la temperatura absoluta siempre que no se modifique el volumen y la cantidad de gas.
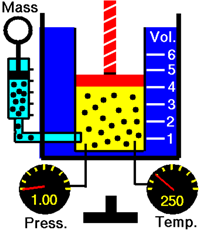
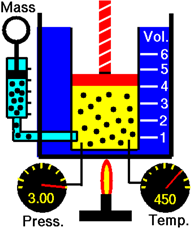
Las formas matemáticas de la ley de Gay-Lussac son las siguientes.
\[P\propto{T}\nonumber\], o\[P=\mathrm{k}T\nonumber\], o\[\frac{P}{T}=\mathrm{k}, \nonumber\]
donde\(k\) es una constante,\(P\) es presión, y\(T\) es la temperatura (en escala kelvin) del gas. Dado que\(\frac{P}{T}\) es una constante, implica que
\[\frac{P_{1}}{T_{1}}=\frac{P_{2}}{T_{2}}=\mathrm{k}, \nonumber\]
donde\(P_1\) está la presión inicial,\(T_1\) es la temperatura inicial en Kelvin,\(P_2\) es la presión final, y\(T_2\) es la temperatura final en Kelvin, siempre que la cantidad de gas y volumen no cambien.
La presión de un tanque de oxígeno que contiene 15.0 L de oxígeno es 965 Torr a 55 o C. Cuál será la presión cuando el tanque se enfríe a 16 o C.
Solución
Primero, convertir las temperaturas a la escala Kelvin antes de aplicar las leyes de gas.
Dado: T 1 = 55 o C + 273.15 = 328.15 K, T 2 = 16 o C + 273.15 = 289.15 K, P 1 = 965 Torr, P 2 =?
Fórmula:
\[\frac{P_{1}}{T_{1}}=\frac{P_{2}}{T_{2}}, \nonumber\]
reorganizar la fórmula para aislar la variable deseada:
\[P_{2}=\frac{P_{1} T_{2}}{T_{1}} \nonumber\]
Conecte los valores en la fórmula rearreglada y calcule:
\[P_{2}=\frac{965 \mathrm{~Torr} \times 298.15\mathrm{~K}}{328.15 \mathrm{~K}}=850 \mathrm{~Torr} \nonumber\]


