7.6: La relación volumen-cantidad
- Page ID
- 77253
La figura\(\PageIndex{1}\) ilustra el efecto de la cantidad de gas sobre el volumen. Agregar más moléculas de gas aumenta la frecuencia de colisión de las moléculas con las paredes aumentando la presión del gas. El gas se expande para reducir la presión hasta que la presión del gas en la cámara es igual a la presión exterior.
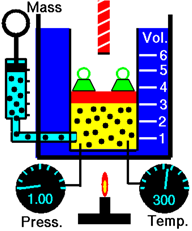
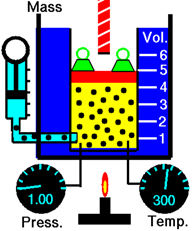
La ley de Avogadro establece que el volumen de un gas es directamente proporcional a la cantidad de gas en moles siempre que no se modifique la temperatura y presión del gas.
Las formas matemáticas de la ley de Avogadro son las siguientes.
\[V\propto {n}\nonumber\]
o
\[V=\mathrm{k}n\nonumber\]
o
\[\dfrac{V}{n}=\mathrm{k}\nonumber\]
donde\(V\) es el volumen,\(n\) es el número de moles, y\(k\) es la constante para el gas bajo condiciones de temperatura y presión constantes. Dado que\(\mathrm{V} / \mathrm{n}\) es una constante, implica que:
\[\dfrac{V_{1}}{n_{1}}=\dfrac{V_{2}}{n_{2}}=\mathrm{k}\nonumber\]
donde\(V_{1}\) y\(n_{1}\) es el volumen inicial y la cantidad inicial de gas, respectivamente, y\(V_{2}\) y\(n_{2}\) es el volumen final y la cantidad final de gas en moles, siempre que no se modifiquen la temperatura y presión.
Un globo meteorológico que contiene\(3.0\) moles de helio tiene un volumen de\(66 \mathrm{~L}\). Cuál es el volumen final si se le agregan\(2.0\) moles de helio. ¿La presión y la temperatura del gas no cambian?
Solución
Dado\(\quad V_{1}=66 L, \quad n_{1}=3.0 \mathrm{~mol}, \quad V_{2}=?, \quad n_{2}=3.0+2.0=5.0 \mathrm{~mol}\)
Fórmula:
\[\dfrac{V_{1}}{n_{1}}=\dfrac{V_{2}}{n_{2}}, \nonumber\]
reorganizar la fórmula para aislar la variable deseada:
\[V_{2}=\dfrac{V_{1} n_{2}}{n_{1}}. \nonumber\]
Enchufe los valores y calcule:
\[V_{2}=\dfrac{66 \mathrm{~L} \times \times 5.0 \mathrm{~mol}}{3.0 \mathrm{~mol}}=110 \mathrm{~L}. \nonumber\]


