6.1: Flujo de calor
- Page ID
- 77548
Resultados de aprendizaje
- Describir cómo la energía potencial química se relaciona con el calor y el trabajo.
- Utilice la ecuación de calor específico para realizar cálculos que relacionen la masa, el calor específico, el cambio de temperatura y la cantidad de calor absorbido o liberado.
- Convertir entre julios, calorías y calorías.
- Definir endotérmico y exotérmico.
- Explicar la diferencia entre el calor y la capacidad calorífica específica.
Las reacciones químicas van acompañadas de transferencias de energía. Hacer un seguimiento del flujo de calor y los requisitos de energía es importante para una comprensión completa de los procesos químicos. La energía es la capacidad para hacer trabajo o suministrar calor. Cuando llenas tu auto de gasolina, lo estás aportando con energía potencial. La energía potencial química es la energía almacenada en los enlaces químicos de una sustancia. Los diversos productos químicos en la gasolina contienen una gran cantidad de energía química potencial que se libera cuando la gasolina se quema de manera controlada en el motor del automóvil. La liberación de esa energía hace dos cosas. Parte de la energía potencial se transforma en trabajo, que se utiliza para mover el automóvil (ver figura a continuación). Al mismo tiempo, parte de la energía potencial se convierte en calor, haciendo que el motor del automóvil esté muy caliente. Los cambios de energía de un sistema ocurren como calor o trabajo, o alguna combinación de ambos.

El calor es energía que se transfiere de un objeto o sustancia a otro debido a una diferencia de temperatura entre ellos. El calor siempre fluye de un objeto a una temperatura más alta a un objeto a una temperatura más baja (ver figura a continuación). El flujo de calor continuará hasta que los dos objetos estén a la misma temperatura.

La termoquímica es el estudio de los cambios energéticos que ocurren durante las reacciones químicas y durante los cambios de estado. Cuando ocurren reacciones químicas, algunos enlaces químicos se rompen, mientras que se forman nuevos enlaces químicos. Como resultado del reordenamiento de los átomos, la energía potencial química total del sistema aumenta o disminuye.
Procesos exotérmicos y endotérmicos
Cuando ocurren cambios físicos o químicos, generalmente van acompañados de una transferencia de energía. La ley de conservación de la energía establece que en ningún proceso físico o químico, la energía no se crea ni se destruye. En otras palabras, se conserva toda la energía en el universo. Para comprender mejor los cambios energéticos que ocurren durante una reacción, necesitamos definir dos partes del universo, llamadas sistema y entorno. El sistema es la porción específica de la materia en un espacio dado que se está estudiando durante un experimento o una observación. El entorno es todo lo que hay en el universo que no forma parte del sistema. En términos prácticos para un químico de laboratorio, el sistema es generalmente la reacción que se investiga, mientras que los alrededores incluyen las inmediaciones dentro de la habitación. Durante la mayoría de los procesos, la energía se intercambia entre el sistema y el entorno. Si el sistema pierde cierta cantidad de energía, esa misma cantidad de energía es ganada por el entorno. Si el sistema gana cierta cantidad de energía, esa energía es suministrada por el entorno.
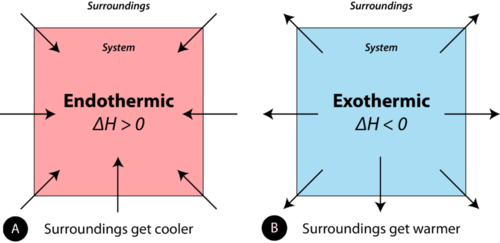
En el estudio de los procesos termoquímicos, las cosas son vistas desde el punto de vista del sistema. Una reacción química o cambio físico es endotérmica si el sistema absorbe el calor del entorno. En el transcurso de un proceso endotérmico, el sistema gana calor del entorno, por lo que la temperatura del entorno disminuye. La cantidad de calor para un proceso está representada por la letra\(q\). El signo de\(q\) para un proceso endotérmico es positivo porque el sistema está ganando calor. Una reacción química o cambio físico es exotérmico si el sistema libera calor al entorno. Debido a que los alrededores están ganando calor del sistema, la temperatura de los alrededores aumenta. El signo de\(q\) para un proceso exotérmico es negativo porque el sistema está perdiendo calor. La diferencia entre una reacción endotérmica y una reacción exotérmica se ilustra a continuación (ver figura a continuación).
Unidades de Calor
El flujo de calor se mide en una de dos unidades comunes: la caloría y la joule. El joule\(\left( \text{J} \right)\) es la unidad de energía SI. La caloría es familiar porque se usa comúnmente cuando se refiere a la cantidad de energía contenida dentro de los alimentos. Una caloría\(\left( \text{cal} \right)\) es la cantidad de calor requerida para elevar la temperatura de 1 gramo de agua por\(1^\text{o} \text{C}\). Por ejemplo, elevar la temperatura\(100 \: \text{g}\) del agua de\(20^\text{o} \text{C}\) a\(22^\text{o} \text{C}\) requeriría\(100 \times 2 = 200 \: \text{cal}\).
Las calorías contenidas dentro de los alimentos son en realidad kilocalorías\(\left( \text{kcal} \right)\). Es decir, si un cierto refrigerio contiene 85 calorías de alimentos, en realidad contiene\(85 \: \text{kcal}\) o\(85,000 \: \text{cal}\). Para hacer la distinción, la caloría dietética se escribe con una C. mayúscula.
\[1 \: \text{kilocalorie} = 1 \: \text{Calorie} = 1000 \: \text{calories}\]
Decir que la merienda “contiene” 85 Calorías significa que\(85 \: \text{kcal}\) de energía se liberan cuando ese refrigerio es procesado por tu cuerpo.
Los cambios de calor en las reacciones químicas se miden típicamente en julios en lugar de calorías. A continuación se muestra la conversión entre un joule y una caloría.
\[1 \: \text{J} = 0.2390 \: \text{cal} \: \text{or} \: 1 \: \text{cal} = 4.184 \: \text{J}\]
Ejemplo\(\PageIndex{1}\)
Cuántos julios de energía se liberan cuando se libera un 400. ¿Se digiere la hamburguesa de calorías?
Solución
Utiliza la relación entre Calorías y calorías que es 1000 calorías\(=\) 1 Calorías y el factor de conversión de julios a calorías para encontrar el valor en julios. Tenga en cuenta que todas las unidades cancelan excepto julios que es lo que se pide en la pregunta.
\[400 \: \text{Cal} \left( \frac{1000 \: \text{cal}}{1 \: \text{Cal}} \right) \left( \frac{4.184 \: \text{J}}{1 \: \text{cal}} \right) = 1.67 \times 10^6 \: \text{J}\]
Capacidad calorífica y calor específico
Si una piscina y un balde, ambos llenos de agua a la misma temperatura, fueran sometidos a la misma entrada de energía térmica, el cubo de agua sin duda aumentaría de temperatura más rápidamente que la piscina. La capacidad calorífica es la cantidad de calor requerida para elevar la temperatura de un objeto por\(1^\text{o} \text{C}\). La capacidad calorífica de un objeto depende tanto de su masa como de su composición química. Debido a su masa mucho mayor, la piscina de agua tiene una mayor capacidad de calor que el cubo de agua.
Diferentes sustancias responden al calor de diferentes maneras. Si una silla de metal se sienta al sol brillante en un día caluroso, puede llegar a ser bastante calurosa al tacto. Una masa igual de agua en el mismo sol no se volverá casi tan caliente. El agua es muy resistente a los cambios de temperatura, mientras que los metales en general no lo son. El calor específico de una sustancia es la cantidad de energía requerida para elevar la temperatura de 1 gramo de la sustancia por\(1^\text{o} \text{C}\). La siguiente tabla enumera el calor específico de algunas sustancias comunes. El símbolo para calor específico es\(C_p\), con el\(p\) subíndice refiriéndose al hecho de que los calores específicos se miden a presión constante. Las unidades para calor específico pueden ser julios por gramo por grado\(\left( \text{J/g} \cdot ^\text{o} \text{C} \right)\), o calorías por gramo por grado\(\left( \text{cal/g} \cdot ^\text{o} \text{C} \right)\). Este texto se utilizará\(\text{J/g} \cdot ^\text{o} \text{C}\) para calor específico. Obsérvese que el calor específico de una sustancia depende no sólo de su identidad sino también de su estado. Por ejemplo, el hielo, el agua líquida y el vapor tienen diferentes valores de calor específicos.
Tabla\(\PageIndex{1}\): Calores Específicos de Algunas Sustancias Comunes
| Sustancia | Calor Específico\(\left( \text{J/g} \cdot ^\text{o} \text{C} \right)\) |
| Agua\(\left( l \right)\) | 4.18 |
| Agua\(\left( s \right)\) | 2.06 |
| Agua\(\left( g \right)\) | 1.87 |
| Amoníaco\(\left( g \right)\) | 2.09 |
| Etanol\(\left( l \right)\) | 2.44 |
| Aluminio\(\left( s \right)\) | 0.897 |
| Carbono, grafito\(\left( s \right)\) | 0.709 |
| Cobre\(\left( s \right)\) | 0.385 |
| Oro\(\left( s \right)\) | 0.129 |
| Hierro\(\left( s \right)\) | 0.449 |
| Plomo\(\left( s \right)\) | 0.129 |
| Mercurio\(\left( l \right)\) | 0.140 |
| Plata\(\left( s \right)\) | 0.233 |
Observe que el agua tiene un calor específico muy alto en comparación con la mayoría de las otras sustancias. El agua se usa comúnmente como refrigerante para maquinaria porque es capaz de absorber grandes cantidades de calor (ver figura abajo). Los climas costeros son mucho más moderados que los climas interiores debido a la presencia del océano. El agua en lagos u océanos absorbe el calor del aire en los días calurosos y lo libera de nuevo al aire en los días fríos.

Cálculos de Calor Específico
El calor específico de una sustancia se puede utilizar para calcular el cambio de temperatura que sufrirá una sustancia determinada cuando se caliente o se enfríe. La ecuación que relaciona el calor\(\left( q \right)\) con el calor específico\(\left( C_p \right)\), la masa\(\left( m \right)\) y el cambio de temperatura\(\left( \Delta T \right)\) se muestra a continuación.
\[q = m \times C_p \times \Delta T\]
El calor que es absorbido o liberado se mide en julios. La masa se mide en gramos. El cambio de temperatura viene dado por\(\Delta T = T_f - T_i\), donde\(T_f\) está la temperatura final y\(T_i\) es la temperatura inicial.
Ejemplo\(\PageIndex{2}\)
Una\(15.0 \: \text{g}\) pieza de metal cadmio absorbe el\(134 \: \text{J}\) calor a medida que aumenta su temperatura de\(24.0^\text{o} \text{C}\) a\(62.7^\text{o} \text{C}\). Calcular el calor específico del cadmio.
Solución
Paso 1: Enumere las cantidades conocidas y planifique el problema.
Conocido
- Calor\(= q = 134 \: \text{J}\)
- Masa\(= m = 15.0 \: \text{g}\)
- \(\Delta T = 62.7^\text{o} \text{C} - 24.0^\text{o} \text{C} = 38.7^\text{o} \text{C}\)
Desconocido
- \(C_p\)de cadmio\(= ? \: \text{J/g} \cdot ^\text{o} \text{C}\)
La ecuación de calor específico se puede reorganizar para resolver el calor específico.
Paso 2: Resolver.
\[C_p = \frac{q}{m \times \Delta T} = \frac{134 \: \text{J}}{15.0 \: \text{g} \times 38.7^\text{o} \text{C}} = 0.231 \: \text{J/g} \cdot ^\text{o} \text{C}\]
Paso 3: Piensa en tu resultado.
El calor específico del cadmio, un metal, es bastante cercano a los calores específicos de otros metales en la tabla anterior. El resultado tiene tres cifras significativas.
Dado que se conocen los calores más específicos, se pueden utilizar para determinar la temperatura final alcanzada por una sustancia cuando se calienta o se enfría. Supongamos que una\(60.0 \: \text{g}\) muestra de agua en\(23.52^\text{o} \text{C}\) fue enfriada por la eliminación fo\(813 \: \text{J}\) de calor. El cambio de temperatura se puede calcular usando la ecuación específica de calor.
\[\Delta T = \frac{q}{C_p \times m} = \frac{-813 \: \text{J}}{4.18 \: \text{J/g} \cdot ^\text{o} \text{C} \times 60.0 \: \text{g}} = -3.24^\text{o} \text{C}\]
Dado que el agua se estaba enfriando, el calor se elimina del sistema. Por lo tanto,\(q\) es negativo, y la temperatura disminuye. La temperatura final es:
\[T_f = 23.52^\text{o} \text{C} - 3.24^\text{o} \text{C} = 20.28^\text{o} \text{C}\]
Recursos Suplementarios
- Energía en Reacciones Químicas: http://www.wisc-online.com/Objects/V...spx? ID=GCH8705
Colaboradores y Atribuciones
CK-12 Foundation by Sharon Bewick, Richard Parsons, Therese Forsythe, Shonna Robinson, and Jean Dupon.
Allison Soult, Ph.D. (Department of Chemistry, University of Kentucky)

