11.7: Propiedades de las Reacciones (Ejercicios)
- Page ID
- 77600
Se trata de ejercicios de tarea para acompañar al Capítulo 11 del LibreTexto de la Universidad de Kentucky para CHE 103 - Química para la Salud Aliada.
Preguntas
(haga clic aquí para obtener soluciones)
Q11.1.1
¿Qué es un elemento libre y cuál es el número de oxidación de los átomos que existen como elemento libre?
Q11.1.2
¿Cuál es el mayor número de oxidación que puede tener el azufre? ¿El más bajo? Considera el número de electrones de valencia que tiene.
Q11.1.3
Determinar los números de oxidación de cada uno de los átomos en lo siguiente.
- KmNo 4
- OCl 2
- H 2 C 2 O 4
- Li 3 PO 4
- NaClO
- Br 2
- CLF 3
- CaCl 2
- K 2 O
Q11.1.4
Determinar el número de oxidación de cada uno de los átomos en los siguientes iones.
- NO 2 −
- NO 3 −
- Cr 2 O 7 2−
- BrO 3 −
- ClO 3 −
- BO 3 3−
- CO 3 2−
- NH 4 +
- CrO 4 2−
- S 2 O 3 2−
(haga clic aquí para obtener soluciones)
Q11.2.1
Explicar por qué la oxidación y la reducción siempre ocurren juntas en una reacción.
Q11.2.2
¿Qué sucede con el agente oxidante en una reacción redox?
Q11.2.3
¿Qué sucede con el agente reductor en una reacción redox?
Q11.2.4
Identificar cada proceso como una oxidación o una reducción.
- Rb → Rb +
- Te → Te 2—
- 2H + → H 2
- P 3— → P
- 2Cl — → Cl 2
- Sn 4 + → Sn 2+
- Br 2 → Br —
- Fe 2 + → Fe 3 +
Q11.2.5
Para cada ecuación, 1) identificar los números de oxidación de cada elemento, 2) determinar si es una reacción redox o no, y para las reacciones redox, 3) identificar las especies que se oxidan y las especies que se están reduciendo, y 4) identificar los agentes oxidantes y reductores.
- 2KClO 3 (s) → 2KCl (s) + 3O 2 (g)
- H 2 (g) + CuO (s) → Cu (s) + H 2 O (l)
- 2Al (s) + 3Sn (NO 3) 2 (aq) → 2Al (NO 3) 3 (aq) + 3Sn (s)
- 2HNO 3 (aq) + 6HI (aq) → 2NO (g) + 3I 2 (s) + 4H 2 O (l)
- AgnO 3 (ac) + NaCl (ac) → AgCl (s) + NaNO 3 (aq)
- 2FeCl 3 (ac) + H 2 S (g) → 2FeCl 2 (ac) + 2HCl (aq) + S (s)
Q11.2.6
Identificar el cambio que se produce con respecto a la ganancia o pérdida de hidrógeno u oxígeno.
| a. | 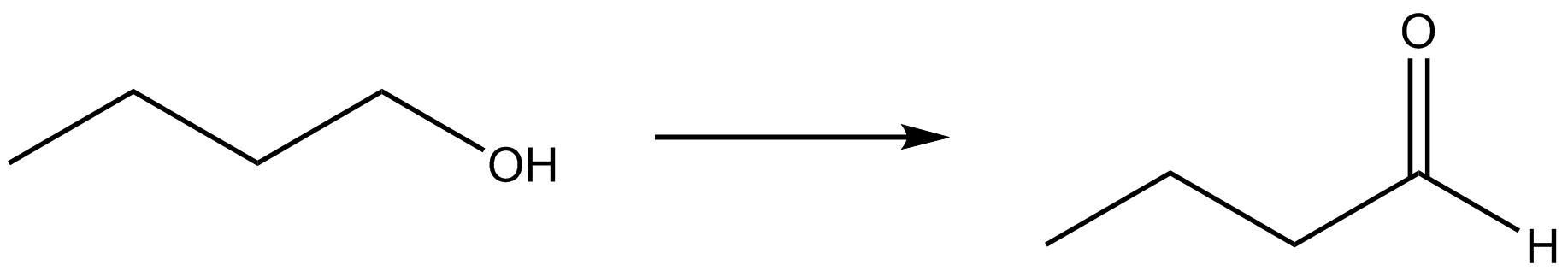 |
| b. | 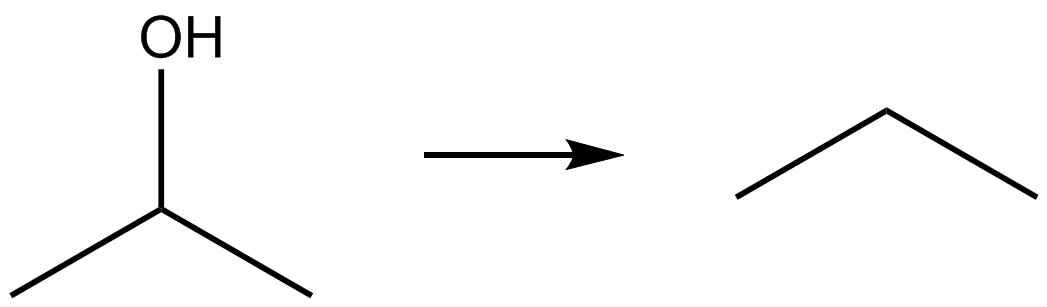 |
| c. | 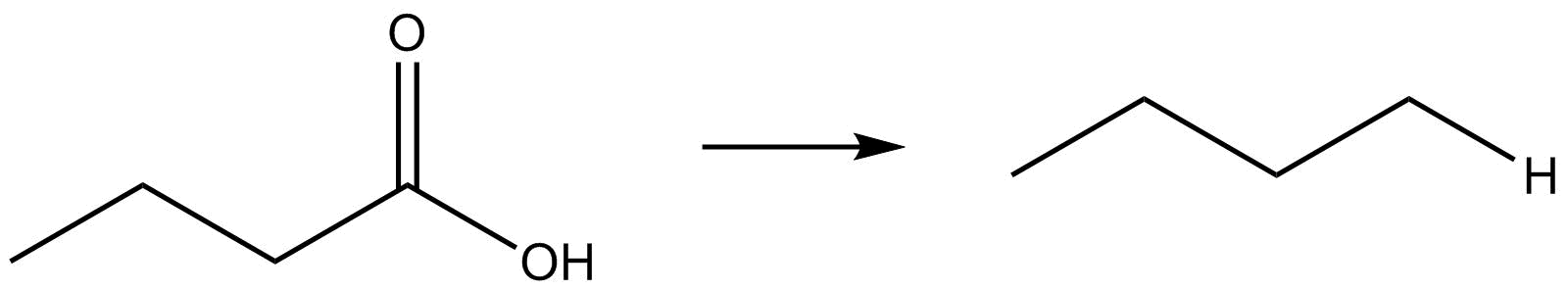 |
| d. | 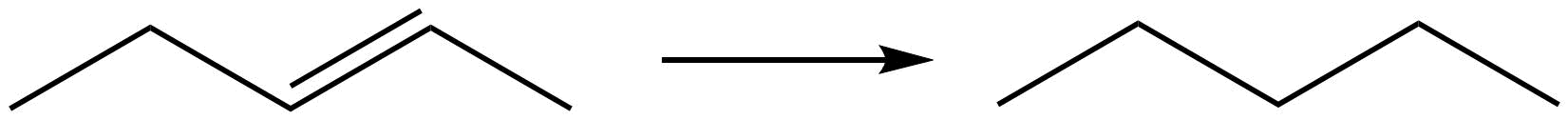 |
| e. |  |
(haga clic aquí para obtener soluciones)
Q11.3.1
Clasifique las siguientes reacciones como combinación, descomposición, reemplazo simple, reemplazo doble o combustión. Para cada uno, indicar si es una reacción redox o no.
- Cd (s) + H 2 SO 4 (aq) → CdSO 4 (aq) + H 2 (g)
- 2Fe (s) + 3Cl 2 (g) → 2FeCl 3 (s)
- C 7 H 8 (l) + 9O 2 (g) → 7CO 2 (g) + 4H 2 O (g)
- 2NH 4 NO 3 (s) → 2N 2 (g) + O 2 (g) + 4H 2 O (g)
- 2CoCl 3 (aq) + 3Pb (NO 3) 2 (aq) → 2Co (NO 3) 3 (aq) + 3PbCl 2 (s)
Q11.3.2
Equilibre las siguientes ecuaciones y clasifique las siguientes reacciones como combinación, descomposición, reemplazo simple, reemplazo doble o combustión. Para cada uno, indicar si es una reacción redox o no.
- Na + Cl 2 → NaCl
- Na 3 PO 4 + KOH → NaOH + K 3 PO 4
- P 4 + O 2 → P 2 O 3
- N 2 + H 2 → NH 3
- Al + HCl → H 2 + AlCl 3
- H 2 O 2 → H 2 O + O 2
- NH 3 + CuO → Cu + N 2 + H 2 O
- NH 4 NO 3 → N 2 O + H 2 O
Q11.3.3
¿Qué tienen en común los productos de las reacciones de combustión?
Q11.3.4
Escriba y equilibre las reacciones de combustión para los siguientes compuestos.
- metano (CH 4)
- propano (C 3 H 8)
- octano (C 8 H 18)
- etanol (CH 3 CH 2 OH)
- sacarosa (C 12 H 22 O 11)
(haga clic aquí para obtener soluciones)
Q11.4.1
En cierta reacción, la energía de los reactivos es menor que la energía de los productos (la reacción consume energía). ¿La reacción es endotérmica o exotérmica?
Q11.4.2
¿Cuáles son las dos fuerzas impulsoras de todas las reacciones químicas y procesos físicos?
Q11.4.3
¿La entropía determina la espontaneidad de una reacción? ¿La entalpía determina la espontaneidad de una reacción?
Q11.4.4
¿Cómo afecta un aumento de la temperatura a la entropía de un sistema?
Q11.4.5
¿Qué sistema tiene la mayor entropía en cada una de las siguientes?
- cloruro de sodio sólido o una solución de cloruro de sodio
- líquido de bromo o vapor de bromo
- 25 g de agua a 80°C o 25 g de agua a 50°C
- mercurio líquido o mercurio sólido
Q11.4.6
¿Cómo cambia la entropía de un sistema para cada uno de los siguientes procesos?
- Un sólido se funde.
- Un líquido se congela.
- Un líquido hierve.
- Un vapor se condensa a un líquido.
- El azúcar se disuelve en agua.
- Un sólido sublima.
(haga clic aquí para obtener soluciones)
Q11.5.1
¿Qué es cierto acerca de las cantidades relativas de reactivos y productos al final de una reacción espontánea?
Q11.5.2
¿Puede una reacción propuesta ser espontánea y, sin embargo, no se puede observar que ocurra? Explique.
Q11.5.3
La reacción directa es espontánea para una reacción reversible particular. ¿Qué se puede concluir sobre la espontaneidad de la reacción inversa?
Q11.5.4
Explique cómo se utiliza la energía libre para determinar si una reacción es espontánea o no.
Q11.5.5
¿Bajo qué condiciones de entalpía y entropía el cambio es una reacción siempre espontánea? ¿Bajo qué condiciones es una reacción nunca espontánea?
Q11.5.6
Si el cambio de entalpía es desfavorable (endotérmico), pero el cambio de entropía es favorable (creciente), ¿sería más probable que una temperatura alta o una temperatura baja condujera a una reacción espontánea?
Q11.5.7
Si el cambio de entalpía es favorable y el cambio de entropía es favorable, ¿la reacción sería espontánea a altas temperaturas, bajas temperaturas o a todas las temperaturas?
(haga clic aquí para obtener soluciones)
Q11.6.1
¿En qué unidad se expresa típicamente la velocidad de una reacción química?
Q11.6.2
Una solución de 2.50 M sufre una reacción química. Después de 3.00 minutos, la concentración de la solución es de 2.15 M. ¿Cuál es la tasa de cambio en M/s?
Q11.6.3
La Sustancia A desaparece a razón de 0.0250 M/s. Si la concentración inicial es de 4.00 M, ¿cuál es la concentración después de un minuto?
Q11.6.4
La concentración del producto B aumenta de 0 a 1.75 M en 45 segundos. ¿Cuál es la tasa de formación de B?
Q11.6.5
La concentración del producto B aumenta de 0.50 M a 1.25 M en 2.5 segundos. ¿Cuál es la tasa de formación de B?
Q11.6.6
El reactivo B pasa de 2.25 M a 1.50 M en 0.85 segundos. ¿Cuál es la tasa de cambio de B?
Q11.6.7
¿Cada colisión entre partículas reaccionantes conduce a la formación de productos? Explique.
Q11.6.8
¿Qué dos condiciones deben cumplirse para que una colisión sea efectiva?
Q11.6.9
Explique por qué la energía de activación de una reacción a veces se denomina barrera.
Q11.6.10
¿Por qué es difícil estudiar complejos activados?
Q11.6.11
Explicar cómo las velocidades de reacción pueden verse afectadas por
- cambios en la concentración.
- cambios en la presión.
- aumento de la superficie.
- cambios en las temperaturas.
Q11.6.12
¿Cuál es el efecto de un catalizador en la velocidad de una reacción?
Q11.6.13
Explicar cómo la presencia de un catalizador afecta la energía de activación de una reacción.
Q11.6.14
El zinc metálico reacciona con el ácido clorhídrico. ¿Cuál resultaría en la velocidad de reacción más alta?
- Una pieza sólida de zinc en HCl 1 M
- Una pieza sólida de zinc en HCl 3 M
- Polvo de zinc en HCl 1 M
- Polvo de zinc en HCl 3 M
Q11.6.15
Utilice el diagrama de energía potencial a continuación para responder a las siguientes preguntas.
- ¿Cuál es la energía potencial de los reactivos?
- ¿Cuál es la energía potencial de los productos?
- ¿Cuál es el calor de reacción (ΔH = E products − E reactantes)?
- ¿Cuál es la energía potencial del complejo activado?
- ¿Cuál es la energía de activación para la reacción?
- ¿La reacción es endotérmica o exotérmica?
- ¿Cuál de los valores en a-e anterior se cambiaría por el uso de un catalizador en la reacción?
- ¿Cuál es la energía de activación de la reacción inversa?
- ¿Cuál es el calor de reacción (ΔH = E productos − E reactantes) de la reacción inversa?
Q11.6.16
Utilice el diagrama de energía potencial a continuación para responder a las siguientes preguntas.
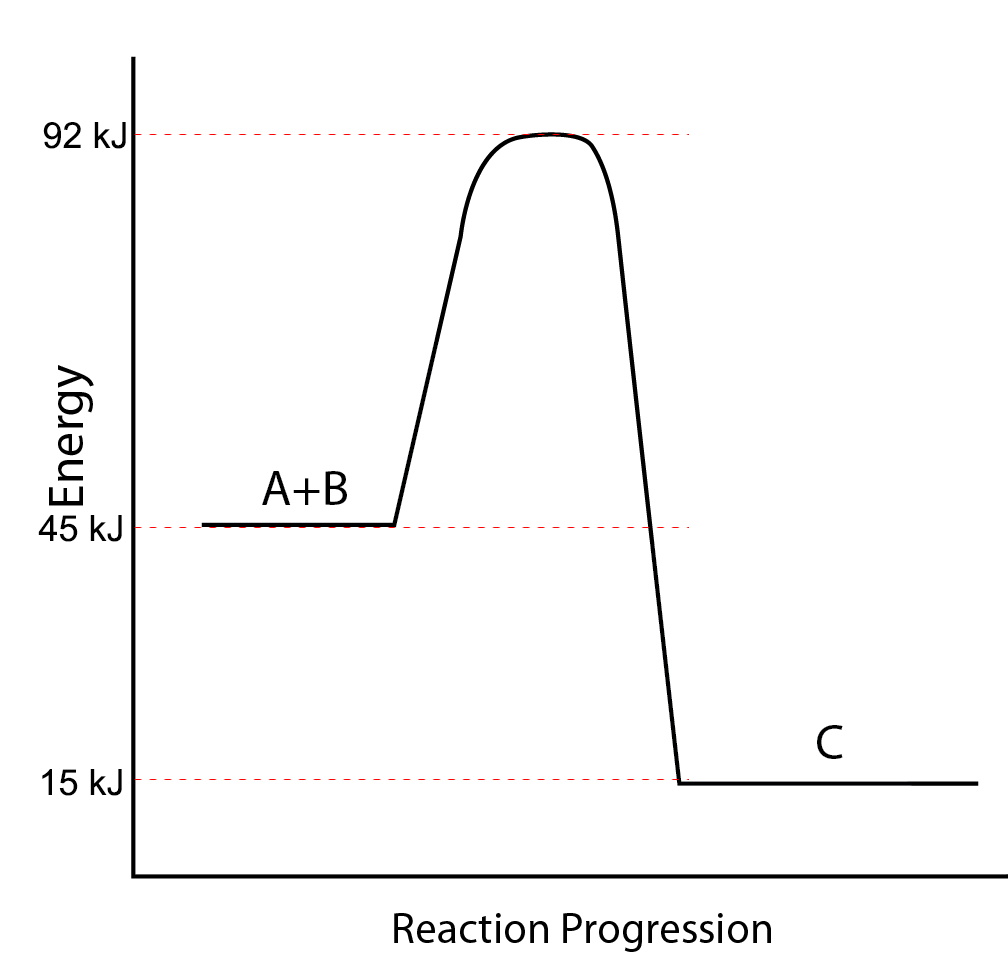
- ¿Cuál es la energía potencial de los reactivos?
- ¿Cuál es la energía potencial de los productos?
- ¿Cuál es el calor de reacción (ΔH = E products − E reactantes)?
- ¿Cuál es la energía potencial del complejo activado?
- ¿Cuál es la energía de activación para la reacción?
- ¿La reacción es endotérmica o exotérmica?
- ¿Cuál de los valores en a-e anterior se cambiaría por el uso de un catalizador en la reacción?
- ¿Cuál es la energía de activación de la reacción inversa?
- ¿Cuál es el calor de reacción (ΔH = E productos − E reactantes) de la reacción inversa?
RESPUESTAS
11.1: Números de oxidación
Q11.1.1
Cualquier elemento por sí mismo, ya sea monatómico o diatómico, sin carga alguna. El número de oxidación de cualquier elemento libre es cero.
Q11.1.2
El azufre puede tener un número de oxidación de hasta +6 o tan bajo como\(-2\).
Q11.1.3
- \(\overset{+1}{\text{K}}\overset{+7}{\text{Mn}}\overset{-2}{\text{O}_4}\)
- Regla 2: K forma un ion con una carga 1+ por lo que su número de oxidación es +1.
- Regla 3: O tiene un número de oxidación de\(-2\).
- Regla 6 para Mn:\ (1+x+4 (-2) =0\\
1+x+-8=0\\
x-7=0\\
x=7\)
- \(\overset{-2}{\text{O}}\overset{+1}{\text{Cl}_2}\)
- Regla 3: O tiene un número de oxidación de\(-2\).
- Regla 6 para Cl:\ (-2+2x=0\\
2x=-2\\
x=1\)
- \(\overset{+1}{\text{H}_2}\overset{+3}{\text{C}_2}\overset{-2}{\text{O}_4}\)
- Regla 3: O tiene un número de oxidación de\(-2\).
- Regla 4: H tiene un número de oxidación de\ {+1\).
- Regla 6 para C:\ (2 (+1) +2x+4 (-2) =0\\
2+2x-8=0\\
2x-6=0\\ 2x=6\\ x=3\)
- \(\overset{+1}{\text{Li}_3}\overset{+5}{\text{P}}\overset{-2}{\text{O}_4}\)
- Regla 2: Li forma un ion con una carga 1+ por lo que su número de oxidación es +1.
- Regla 3: O tiene un número de oxidación de\(-2\).
- Regla 6 para P:\ (3 (+1) +x+4 (-2) =0\\
3+x+-8=0\\
x-5=0\\
x=5\)
- \(\overset{+1}{\text{Na}}\overset{+1}{\text{Cl}}\overset{-2}{\text{O}}\)
- Regla 2: El Na forma un ion con una carga 1+ por lo que su número de oxidación es +1.
- Regla 3: O tiene un número de oxidación de\(-2\).
- Regla 6 para Cl:\ (1+x+-2=0\\
x-1=0\\
x=1\)
- \(\overset{0}{\text{Br}_2}\)
- Regla 1: El número de oxidación de un elemento libre es cero.
- \(\overset{+3}{\text{Cl}} \overset{-1}{\text{F}_3}\)
- Regla 5: F tiene un número de oxidación de\(-1\).
- Regla 6 para Cl:\(x+3(-1)=0\\ x-3=0\\ x=3\)
- \(\overset{+2}{\text{Ca}}\overset{-1}{\text{Cl}_2}\)
- Regla 2: El Ca forma un ion con una carga 2+ por lo que su número de oxidación es +2.
- Regla 6 para Cl:\ (2+2 (x) =0\\
2x=-2\\
x=-1\)
- \(\overset{+1}{\text{K}_2}\overset{-2}{\text{O}}\)
- Regla 2: K forma un ion con una carga 1+ por lo que su número de oxidación es +1.
- Regla 3: O tiene un número de oxidación de\(-2\).
Q11.1.4
Determinar el número de oxidación de cada uno de los átomos en los siguientes iones.
- \(\overset{+3}{\text{N}}\overset{-2}{\text{O}^-_2}\)
- Regla 2: O tiene un número de oxidación de\(-2\).
- Regla 7 para N:\ (x+2 (-2) =-1\\
x-4=-1\\
x=3\)
- \(\overset{+5}{\text{N}}\overset{-2}{\text{O}^-_3}\)
- Regla 2: O tiene un número de oxidación de\(-2\).
- Regla 7 para N:\ (x+3 (-2) =-1\\
x-6=-1\\
x=5\)
- \(\overset{+6}{\text{Cr}_2}\overset{-2}{\text{O}^{2-}_7}\)
- Regla 2: O tiene un número de oxidación de\(-2\).
- Regla 7 para Cr:\ (2x+7 (-2) =-2\\
2x-14=-2\\
2x=12\
x=6\)
- \(\overset{+5}{\text{Br}}\overset{-2}{\text{O}^-_3}\)
- Regla 2: O tiene un número de oxidación de\(-2\).
- Regla 7 para Br:\ (x+3 (-2) =-1\\
x-6=-1\\
x=5\)
- \(\overset{+5}{\text{Cl}}\overset{-2}{\text{O}^-_3}\)
- Regla 2: O tiene un número de oxidación de\(-2\).
- Regla 7 para Cl:\ (x+3 (-2) =-1\\
x-6=-1\
x=5\)
- \(\overset{+3}{\text{B}}\overset{-2}{\text{O}^-_3}\)
- Regla 2: O tiene un número de oxidación de\(-2\).
- Regla 7 para B:\ (x+3 (-2) =-3\\
x-6=-3\\
x=3\)
- \(\overset{+4}{\text{C}}\overset{-2}{\text{O}^{2-}_3}\)
- Regla 2: O tiene un número de oxidación de\(-2\).
- Regla 7 para C:\ (x+3 (-2) =-2\\
x-6=-2\
x=4\)
- \(\overset{-3}{\text{N}}\overset{+1}{\text{H}^+_4}\)
- Regla 2: H tiene un número de oxidación de\(+1\).
- Regla 7 para N:\ (x+4 (+1) =+1\\
x+4=1\\
x=-3\)
- \(\overset{+6}{\text{Cr}}\overset{-2}{\text{O}^{2-}_4}\)
- Regla 2: O tiene un número de oxidación de\(-2\).
- Regla 7 para Cr:\ (x+4 (-2) =-2\\
x-8=-2\\
x=6\)
- \(\overset{+2}{\text{S}_2}\overset{-2}{\text{O}^{2-}_3}\)
- Regla 2: O tiene un número de oxidación de\(-2\).
- Regla 7 para S:\ (2x+3 (-2) =-2\\
2x-6=-2\\
2x=4\
x=2\)
11.2: La naturaleza de la oxidación y reducción
Q11.2.1
La identificación y reducción del buey son procesos opuestos. Los electrones son perdidos por una sustancia y ganados por otra por lo que tienen una transferencia de electrones.
Q11.2.2
El agente oxidante se reduce.
Q11.2.3
El agente reductor se oxida.
Q11.2.4
- oxidación
- reducción
- reducción
- oxidación
- oxidación
- reducción
- reducción
- oxidación
Q11.2.5
- 2KClO 3 (s) → 2KCl (s) + 3O 2 (g)
- \(\overset{+1}{2\text{K}}\overset{+5}{\text{Cl}}\overset{-2}{\text{O}_3}\rightarrow \overset{+1}{2\text{K}}\overset{-1}{\text{Cl}}~+~\overset{0}{3\text{O}_2}\)
- redox
- el oxígeno está siendo oxidado, el cloro se está reduciendo
- KClO 3 es el agente oxidante y reductor (específicamente, el oxígeno es el agente reductor y el cloro es el agente oxidante)
- H 2 (g) + CuO (s) → Cu (s) + H 2 O (l)
- \(\overset{0}{\text{H}_2}~+~\overset{+2}{\text{Cu}}\overset{-2}{\text{O}}\rightarrow \overset{0}{\text{Cu}}~+~\overset{+1}{\text{H}_2}\overset{-2}{\text{O}}\)
- redox
- el hidrógeno está siendo oxidado, el cobre se está reduciendo
- CuO es el agente oxidante, H 2 es el agente reductor
- 2Al (s) + 3Sn (NO 3) 2 (aq) → 2Al (NO 3) 3 (aq) + 3Sn (s)
- \ (overset {0} {2\ text {Al}} ~+~\ overset {+2} {3\ text {Sn}}\ overset {+5} {\ text {(N}}\ overset {-2} {\ text {O} _3\ text {)} _2}\ fila derecha\ overset {+3} {2\ texto {Al}}\ overset {+5}
{\ texto {(N}}\ overset {-2} {\ text {O} _3\ text {)} _3} ~+~\ overset {0} {3\ text {Sn}}\) - redox
- el aluminio está siendo oxidado, el estaño se está reduciendo
- Sn (NO 3) 2 es el agente oxidante, Al es el agente reductor
- \ (overset {0} {2\ text {Al}} ~+~\ overset {+2} {3\ text {Sn}}\ overset {+5} {\ text {(N}}\ overset {-2} {\ text {O} _3\ text {)} _2}\ fila derecha\ overset {+3} {2\ texto {Al}}\ overset {+5}
- 2HNO 3 (aq) + 6HI (aq) → 2NO (g) + 3I 2 (s) + 4H 2 O (l)
- \(\overset{+1}{2\text{H}}\overset{+5}{\text{N}}\overset{-2}{\text{O}_3}~+~\overset{+1}{6\text{H}}\overset{-1}{\text{I}} \rightarrow \overset{+2}{2\text{N}}\overset{-2}{\text{O}}~+~\overset{0} {3\text{I}_2}~+~\overset{+1}{4\text{H}_2}\overset{-2}{\text{O}}\)
- redox
- iodine is being oxidized, nitrogen is being reduced
- HNO3 is the oxidizing agent, HI is the reducing agent
- AgNO3(aq) + NaCl(aq) → AgCl(s) + NaNO3(aq)
- \(\overset{+1}{\text{Ag}}\overset{+5}{\text{N}}\overset{-2}{\text{O}_3}~+~\overset{+1}{\text{Na}}\overset{-1}{\text{Cl}} \rightarrow \overset{+1}{\text{Ag}}\overset{-1}{\text{Cl}}~+~\overset{+1}{\text{Na}}\overset{+5}{\text{N}}\overset{-2}{\text{O}_3}\)
- not redox
- 2FeCl3(aq) + H2S(g) → 2FeCl2(aq) + 2HCl(aq) + S(s)
- \(\overset{+3}{2\text{Fe}}\overset{-1}{\text{Cl}_3}~+~\overset{+1}{\text{H}_2}\overset{-2}{\text{S}} \rightarrow \overset{+2}{2\text{Fe}}\overset{-1}{\text{Cl}_2}~+~\overset{+1}{2\text{H}}\overset{-1}{\text{Cl}}~+~\overset{0}{\text{S}}\)
- redox
- sulfur is being oxidized, iron is being reduced
- FeCl3 is the oxidizing agent, H2S is the reducing agent
Q11.2.6
- Oxidation due to loss of hydrogen.
- Reduction due to loss of oxygen.
- Reduction due to loss of oxygen or gain of hydrogen.
- Reduction due to gain of hydrogen.
- Reduction due to gain of hydrogen.
11.3: Types of Chemical Reactions
Q11.3.1
- single replacement (single displacement), redox
- combination (synthesis), redox
- combustion, redox
- decomposition, redox
- double replacement (double displacement), not redox
Q11.3.2
- 2Na + Cl2 → 2NaCl, combination (synthesis), redox
- Na3PO4 + 3KOH → 3NaOH + K3PO4, double replacement (double displacement), not redox
- P4 + 3O2 → 2P2O3, combination (synthesis), redox
- N2 + 3H2 → 2NH3, combination (synthesis), redox
- 2Al + 6HCl → 3H2 + 2AlCl3, single replacement (single displacement), redox
- 2H2O2 → 2H2O + O2, decomposition, redox
- 2NH3 + 3CuO → 3Cu + N2 + 3H2O, decomposition, redox
- NH4NO3 → N2O + 2H2O, decomposition, not redox
Q11.3.3
Combustion produces CO2 and H2O.
Q11.3.4
- CH4 + 2O2 → CO2 + 2H2O
- C3H8 + 5O2 → 3CO2 + 4H2O
- 2C8H18 + 25O2 → 16CO2 + 18H2O
- CH3CH2OH + 3O2 → 2CO2 + 3H2O
- C12H22O11 + 12O2 → 12CO2 + 11H2O
11.4: Entropy
Q11.4.1
endothermic
Q11.4.2
enthalpy and entropy
Q11.4.3
Neither entropy nor enthalpy determine the spontaneity of a reaction but both contribute to determining the spontaneity.
Q11.4.4
Entropy increases with temperature.
Q11.4.5
Which system has the greater entropy in each of the following?
- solution
- vapor
- 80°C
- liquid
Q11.4.6
How does the entropy of a system change for each of the following processes?
- increases
- decreases
- increasese
- decreases
- increases
- increases
11.5: Spontaneous Reactions and Free Energy
Q11.5.1
There are more products than reactants.
Q11.5.2
Yes, because it is a very slow reaction.
Q11.5.3
The reverse reaction is not spontaneous.
Q11.5.4
Free energy (\(\Delta G\)) is negative for spontaneous reactions and positive for non-spontaneous reactions.
Q11.5.5
\(\Delta G\) is negative (spontaneous) at all temperatures when \(\Delta H\) is negative and \(\Delta S\) is positive.
\(\Delta G\) is positive (non-spontaneous) at all temperatures when \(\Delta H\) is positive and \(\Delta S\) is negative.
Q11.5.6
high temperature
Q11.5.7
all temperatures
11.6: Rates of Reactions
Q11.6.1
molarity per second, \(\frac{M}{s}\) (may be written as \(Ms^{-1}\))
Q11.6.2
\(rate=\frac{\Delta [A]}{\Delta t}\\=\frac{2.15-2.50\;M}{180. \;s}\\ =\frac{-0.35\;M}{180.\;s}\\ =-0.0019\;\frac{M}{s}\)
Q11.6.3
\(60\;s\left(\frac{0.0250\;M}{s}\right)=1.50\;M\;\text{lost}\\
initial + change =final\\
4.00\;M+(-1.50\;M)=2.50\;M\)
Q11.6.4
\(rate=\frac{\Delta [B]}{\Delta t}\\=\frac{1.75-0\;M}{45 \;s}\\ =0.039\;\frac{M}{s}\)
Q11.6.5
\(rate=\frac{\Delta [B]}{\Delta t}\\=\frac{1.25-0.50\;M}{2.5 \;s}\\ =\frac{0.75\;M}{2.5\;s}\\ =0.30\;\frac{M}{s}\)
Q11.6.6
\(rate=\frac{\Delta [B]}{\Delta t}\\=\frac{1.50-2.25\;M}{0.85 \;s}\\ =\frac{-0.75\;M}{0.85\;s}\\ =-0.88\;\frac{M}{s}\)
Q11.6.7
No, porque las colisiones tienen que ocurrir en la orientación correcta con suficiente energía.
Q11.6.8
Orientación correcta y energía suficiente.
Q11.6.9
Porque es el requerimiento energético el que debe cumplirse antes de que pueda ocurrir la reacción. Cuando no hay suficiente energía, se impide que se produzca la reacción.
Q11.6.10
Son muy efímeros.
Q11.6.11
- El aumento de la concentración aumenta la probabilidad de una colisión efectiva por lo que la velocidad de reacción aumentará. Lo contrario es cierto para una disminución en la concentración.
- El cambio en la presión de una sustancia involucrada en la reacción tendrá el mismo efecto que un cambio en la concentración.
- El aumento de la superficie crea más lugares para que los reactivos interactúen, lo que aumentará la probabilidad de una colisión efectiva, por lo que la velocidad de reacción aumentará.
- Al aumentar la temperatura se incrementará la energía de las colisiones por lo que un mayor número de colisiones tendrá suficiente energía para superar la barrera de activación lo que resultará en un aumento en la velocidad de reacción. Disminuir la temperatura tendrá el efecto inverso.
Q11.6.12
Los catalizadores aumentan la velocidad de una reacción al disminuir la energía de activación.
Q11.6.13
Los catalizadores proporcionan un mecanismo alternativo o “ruta” para que ocurra la reacción. Este nuevo mecanismo tiene una menor energía de activación por lo que más colisiones tienen suficiente energía para superar la barrera lo que aumentará la velocidad de reacción.
Q11.6.14
d. El polvo tiene una superficie mayor que una pieza sólida de zinc y la mayor concentración dará como resultado una mayor velocidad de reacción.
Q11.6.15
- 20 kJ/mol
- 50 kJ/mol
- 30 kJ/mol
- 100 kJ/mol
- 80 kJ/mol
- endotérmico
- d (energía del complejo activado) y e (energía de activación)
- 50 kJ/mol
- \(-\)30 kJ/mol
Q11.6.16
- 45 kJ/mol
- 15 kJ/mol
- \(-\)30 kJ/mol
- 92 kJ/mol
- 47 kJ/mol
- exotérmico
- d (energía del complejo activado) y e (energía de activación)
- 77 kJ/mol
- 30 kJ/mol


