2.3: Isótopos y peso atómico
- Page ID
- 73363
Objetivos de aprendizaje
- Explique en qué se diferencian los isótopos entre sí.
- Calcular la masa atómica de un elemento a partir de las masas y porcentajes relativos de los isótopos del elemento.
Isótopos
Como se introdujo anteriormente, los átomos de un elemento específico se distinguen de otros elementos por su número atómico, (el número de protones). Los átomos del mismo elemento siempre tienen el mismo número de protones, sin embargo, el número de neutrones puede variar. Los isótopos son átomos del mismo elemento que contienen diferentes números de neutrones. Esta diferencia en la cantidad de neutrones afecta al número de masa (A) pero no al número atómico (Z). En un laboratorio químico aparecen isótopos de un elemento y reaccionan igual. Por esta razón, es difícil distinguir entre diferentes isótopos. En contraste, los científicos nucleares pueden identificar y separar diferentes tipos de núcleos atómicos. La tecnología requerida para este proceso es más sofisticada que la que se podría encontrar en un laboratorio químico típico.
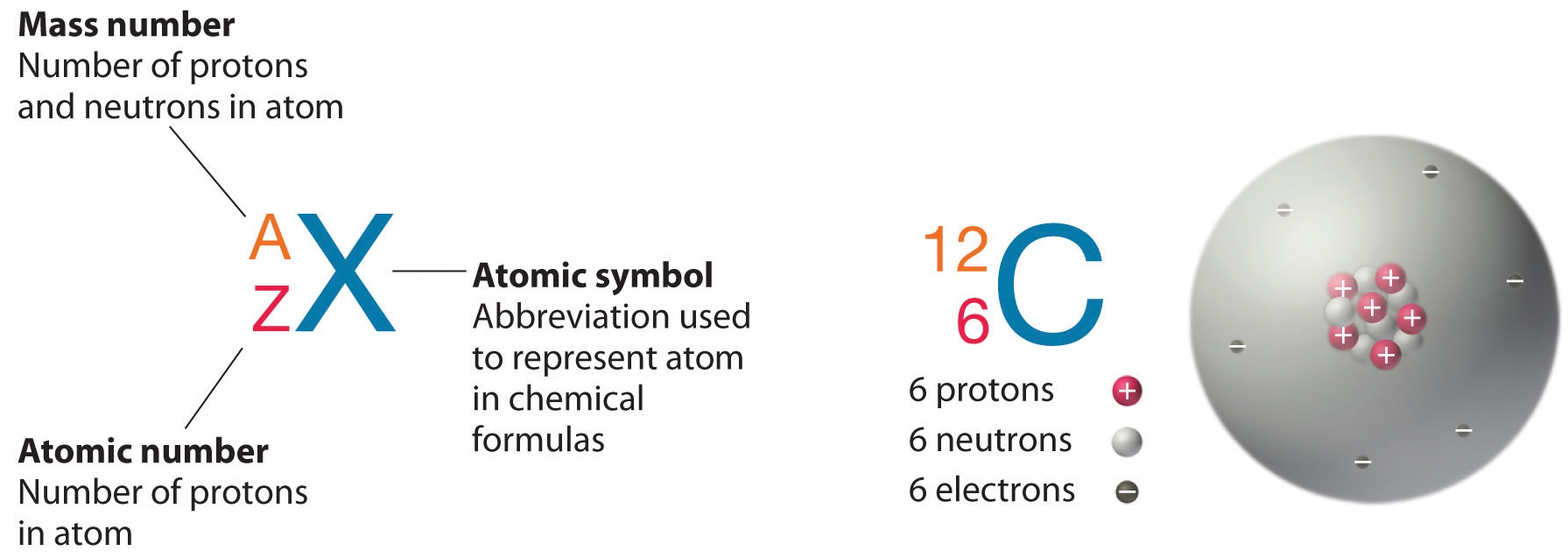
La figura\(\PageIndex{1}\) muestra una manera fácil de representar isótopos con un símbolo nuclear, que incluye el símbolo atómico o elemento (representado por\(X\)), el número de masa\(A\), y el número atómico,\(Z\). Así, para el isótopo de carbono que tiene 6 protones y 6 neutrones, el símbolo es:
\[\ce{_{6}^{12}C} \nonumber\]
donde\(C\) es el símbolo para carbono, 6 representa el número atómico y 12 representa el número de masa.
También es común indicar el número de masa después del nombre de un elemento para indicar un isótopo en particular. El carbono-12 representa un isótopo de carbono con 6 protones y 6 neutrones, mientras que el uranio-238 es un isótopo de uranio que tiene 92 protones y 146 neutrones.
La mayoría de los elementos de la tabla periódica tienen al menos dos isótopos estables. Por ejemplo, además de\(\ce{^{12}C}\), una muestra típica de carbono contiene 1.11%\(\ce{_6^{13}C}\), con 7 neutrones y 6 protones, y una traza de\(\ce{_6^{14}C}\), con 8 neutrones y 6 protones. El núcleo de no\(\ce{_6^{14}C}\) es estable, sin embargo, pero sufre una lenta desintegración radiactiva que es la base de la técnica de datación por carbono-14 utilizada en arqueología. Muchos elementos distintos al carbono tienen más de un isótopo estable; el estaño, por ejemplo, tiene 10 isótopos. Hay alrededor de veinte elementos que existen en una sola forma isotópica (el sodio y el flúor son ejemplos de estos).
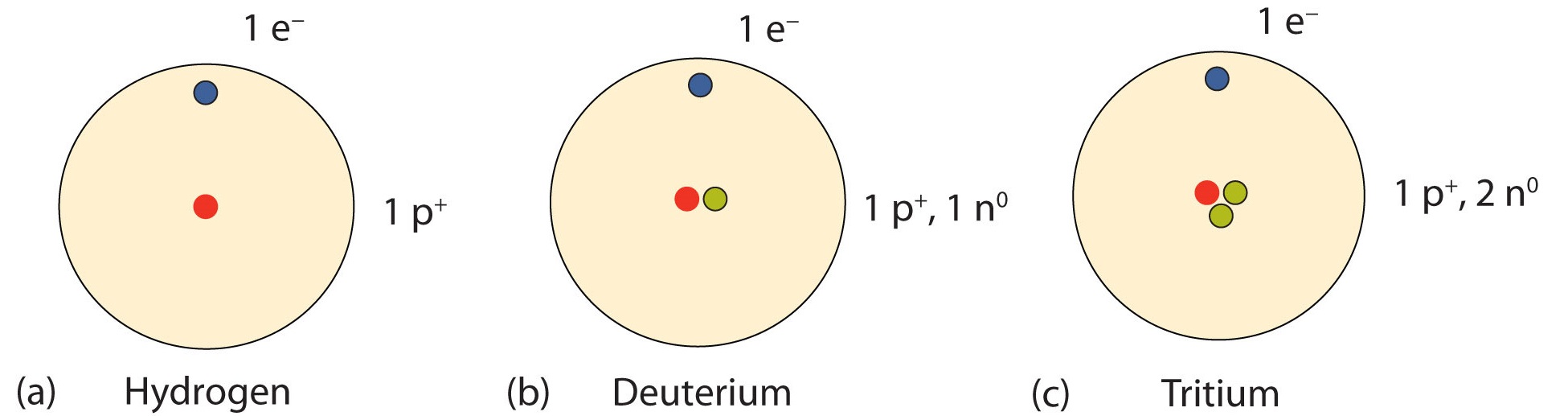
Se encuentra una serie importante de isótopos con átomos de hidrógeno. La mayoría de los átomos de hidrógeno tienen un núcleo con un solo protón. Alrededor de 1 de cada 10,000 núcleos de hidrógeno, sin embargo, también tiene un neutrón; este isótopo en particular se llama deuterio. Un isótopo de hidrógeno extremadamente raro, el tritio, tiene 1 protón y 2 neutrones en su núcleo. La figura\(\PageIndex{2}\) compara los tres isótopos de hidrógeno.
Actualmente hay más de 3,500 isótopos conocidos por todos los elementos. Cuando los científicos discuten isótopos individuales, necesitan una forma eficiente de especificar el número de neutrones en cualquier núcleo en particular. Los formatos A/Z y simbolo-masa se pueden usar para mostrar información de tabla periódica. Al ver cualquiera de estas dos notaciones, se pueden obtener diferencias isotópicas.
El descubrimiento de isótopos requirió un cambio menor en la teoría atómica de Dalton. Dalton pensó que todos los átomos del mismo elemento eran exactamente iguales.
Observa los formatos A/Z para los tres isótopos de hidrógeno en la Tabla\(\PageIndex{1}\). Observe cómo el número atómico (valor inferior) sigue siendo el mismo mientras que se varían las masas atómicas (número superior). Todos los isótopos de un elemento en particular variarán en neutrones y masa. Esta varianza en masa también será visible en el formato simbólico-masa de los mismos isótopos.
| Nombre común | Formatos A/Z | formato simbolo-masa | Nombre ampliado |
|---|---|---|---|
| Hidrógeno | \(\mathrm{^{1}_{1}H}\) | \(\text{H-1}\) | hidrógeno-1 |
| Deuterio | \(\mathrm{^{2}_{1}H}\) | \(\text{H-2}\) | hidrógeno-2 |
| Tritio | \(\mathrm{^{3}_{1}H}\) | \(\text{H-3}\) | hidrógeno-3 |
Ambos formatos A/Z o simbolo-masa se pueden utilizar para determinar la cantidad de partículas subatómicas (protones, neutrones y electrones) contenidas dentro de un isótopo. Cuando se le da cualquiera de los dos formatos, estos valores de masa deben ser utilizados para calcular el número de neutrones en el núcleo.
Peso atómico
Dado que la mayoría de las muestras de elementos naturales son mezclas de isótopos, es útil usar un peso promedio de un elemento. La masa atómica de un elemento es la masa ponderada de todos los isótopos naturalmente presentados (en la tierra). Para determinar la forma isotópica más abundante de un elemento, compare los isótopos dados con el promedio ponderado en la tabla periódica. Por ejemplo, los tres isótopos de hidrógeno en la Figura\(\PageIndex{2}\) son H-1, H-2 y H-3. La masa atómica o promedio ponderado del hidrógeno es de alrededor de 1.008 amu (mira de nuevo a la tabla periódica). De los tres isótopos de hidrógeno, H-1 es el más cercano en masa al promedio ponderado; por lo tanto, es el más abundante. Los otros dos isótopos de hidrógeno son bastante raros, pero son muy emocionantes en el mundo de la ciencia nuclear.
Puede calcular la masa atómica (o masa promedio) de un elemento siempre que conozca las abundancias relativas (la fracción de un elemento que es un isótopo dado), los isótopos naturales del elemento y las masas de esos diferentes isótopos. Podemos calcular esto mediante la siguiente ecuación:
\[\text{Atomic mass} = \left( \%_1 \right) \left( \text{mass}_1 \right) + \left( \%_2 \right) \left( \text{mass}_2 \right) + \cdots \label{eq1}\]
Los promedios como la ecuación 1 se conocen como promedios ponderados. La masa atómica de un elemento se puede calcular siempre que se conozcan las abundancias relativas de los isótopos naturales del elemento y se conozcan las masas de esos isótopos. Si no se proporcionan todas las abundancias, es seguro asumir que todos los números deben sumar hasta el 100%.
Por ejemplo, el boro tiene dos isótopos naturales. En una muestra de boro,\(20\%\) de los átomos son\(\text{B-10}\), que es un isótopo de boro con 5 neutrones y masa de\(10 \: \text{amu}\). El otro\(80\%\) de los átomos son\(\text{B-11}\), que es un isótopo de boro con 6 neutrones y una masa de\(11 \: \text{amu}\). ¿Cómo calculamos la masa atómica del boro?
El boro tiene dos isótopos por lo que usaremos la Ecuación\ ref {eq1} y sustituiremos las abundancias relativas y las masas atómicas de Boro en la Ecuación\ ref {eq1}:
\[\begin{align} \text{Atomic mass} &= \left( 0.20 \right) \left( 10 \right) + \left( 0.80 \right) \left( 11 \right) \nonumber \\ &= 10.8 \: \text{amu}\nonumber \end{align}\nonumber \]
La masa de un átomo de boro promedio, y por lo tanto la masa atómica del boro, es\(10.8 \: \text{amu}\).
Ejemplo\(\PageIndex{1}\): Peso atómico del neón
El neón tiene tres isótopos naturales. En una muestra de neón,\(90.92\%\) de los átomos son\(\ce{Ne}\) -20, que es un isótopo de neón con 10 neutrones y una masa de\(19.99 \: \text{amu}\). Otro\(0.3\%\) de los átomos son\(\ce{Ne}\) -21, que es un isótopo de neón con 11 neutrones y una masa de\(20.99 \: \text{amu}\). El final\(8.85\%\) de los átomos son\(\ce{Ne}\) -22, que es un isótopo de neón con 12 neutrones y una masa de\(21.99 \: \text{amu}\). ¿Cuál es la masa atómica del neón?
Solución
El neón tiene tres isótopos. Usaremos la ecuación:
\[\text{Atomic mass} = \left( \%_1 \right) \left( \text{mass}_1 \right) + \left( \%_2 \right) \left( \text{mass}_2 \right) + \cdots \nonumber\]
Sustituir estos en la ecuación, y obtenemos:
\[\begin{align*} \text{Atomic mass} &= \left( 0.9092 \right) \left( 19.99 \right) + \left( 0.003 \right) \left( 20.99 \right) + \left( 0.0885 \right) \left( 21.99 \right) \\ &= 20.17 \: \text{amu} \end{align*}\]
La masa de un átomo de neón promedio es\(20.17 \: \text{amu}\)
Ejercicio\(\PageIndex{1}\)
El magnesio tiene los tres isótopos enumerados en la siguiente tabla:
| Isótopo | Masa exacta (amu) | Porcentaje de Abundancia (%) |
|---|---|---|
| 24 Mg | 23.98504 | 78.70 |
| 25 Mg | 24.98584 | 10.13 |
| 26 Mg | 25.98259 | 11.17 |
Utilice estos datos para calcular la masa atómica del magnesio.
- Responder
-
24.31 amu
Aplicaciones de Isótopos
Durante el proyecto Manhattan, la mayor parte del financiamiento federal se dedicó a la separación de isótopos de uranio. Los dos isótopos más comunes de uranio son U-238 y U-235. Alrededor del 99.3% del uranio es de la variedad U-238, esta forma no es fisionable y no funcionará en un arma nuclear o reacción. El 0.7% restante es U-235 que es fisionable, pero primero tuvo que separarse del U-238. Este proceso de separación se llama enriquecimiento. Durante la Segunda Guerra Mundial, se construyó una instalación nuclear en Oak Ridge, Tennessee para llevar a cabo este proyecto. En su momento, el proceso de enriquecimiento sólo produjo suficiente U-235 para una sola arma nuclear. Este combustible se colocó dentro de la más pequeña de las dos bombas atómicas (Little Boy) que cayó sobre Japón.

El uranio es un elemento natural que se puede encontrar en varios países diferentes. Los países que no cuentan con suministros de uranio natural necesitarían obtenerlo de uno de los países a continuación. La mayoría de los reactores nucleares que proporcionan energía dependen del U-235 como fuente de combustible. Afortunadamente, los reactores solo necesitan 2-5% U-235 para la producción de megavatios o incluso gigavatios de potencia. Si el proceso de purificación supera este nivel, entonces es probable que un país se esté enfocando en fabricar armas nucleares. Por ejemplo, los científicos del Proyecto Manhattan enriquecieron hasta 90% U-235 con el fin de producir el arma Little Boy.
Abreviaturas como UHE (uranio altamente enriquecido) y LEU (uranio poco enriquecido) son utilizadas frecuentemente por científicos y grupos nucleares. El UHE se define como más del 20% de U-235 puro y no se usaría en la mayoría de los reactores nucleares comerciales. Este tipo de material se utiliza para alimentar submarinos y portaaviones más grandes. Si la purificación del U-235 alcanza el 90%, entonces el UME se clasifica además como material de grado armamentístico. Este tipo de U-235 podría utilizarse para fabricar un arma nuclear (basada en fisión o incluso fusión). En cuanto al LEU, su nivel U-235 estaría por debajo de esta marca del 20%. El LEU se utilizaría para reactores nucleares comerciales y submarinos más pequeños propulsados por energía nuclear. El LEU no es lo suficientemente puro como para ser utilizado en un arma nuclear convencional, sino que podría usarse en una bomba sucia. Este tipo de arma utiliza explosivos convencionales como la dinamita para difundir material nuclear. A diferencia de un arma nuclear, las bombas sucias no son lo suficientemente poderosas como para afectar a grandes grupos de edificios o personas. Desafortunadamente, la difusión de material nuclear causaría un caos masivo para una comunidad y daría lugar a bajas.
Resumen
- Los isótopos de un elemento tienen diferentes masas y se identifican por sus números de masa.
- La masa atómica de un elemento es el promedio ponderado de las masas de los isótopos de un elemento
- La masa atómica de un elemento se puede calcular siempre que se conozcan las abundancias relativas de los isótopos naturales del elemento y se conozcan las masas de esos isótopos. Si no se proporcionan todas las abundancias, es seguro asumir que todos los números deben sumar hasta el 100%.
Ejercicios de revisión de conceptos
- ¿Por qué el número atómico es tan importante para la identidad de un átomo?
- ¿Cuál es la relación entre el número de protones y el número de electrones en un átomo?
- ¿En qué se diferencian los isótopos de un elemento entre sí?
- ¿Cuál es el número de masa de un elemento?
RESPUESTAS
- El número atómico define la identidad de un elemento. Describe el número de protones en el núcleo.
- En un átomo eléctricamente neutro, el número de protones es igual al número de electrones.
- Los isótopos de un elemento tienen el mismo número de protones pero tienen diferentes números de neutrones en sus núcleos.
- El número de masa es la suma de los números de protones y neutrones en el núcleo de un átomo.
Colaboradores y Atribuciones
CK-12 Foundation by Sharon Bewick, Richard Parsons, Therese Forsythe, Shonna Robinson, and Jean Dupon.

