2.4: La Tabla Periódica
- Page ID
- 73350
Objetivos de aprendizaje
- Explicar cómo se organizan los elementos en la tabla periódica.
- Describir cómo algunas características de los elementos se relacionan con sus posiciones en la tabla periódica.
En el siglo XIX, se descubrieron muchos elementos previamente desconocidos, y los científicos notaron que ciertos conjuntos de elementos tenían propiedades químicas similares. Por ejemplo, el cloro, el bromo y el yodo reaccionan con otros elementos (como el sodio) para producir compuestos similares. Asimismo, el litio, el sodio y el potasio reaccionan con otros elementos (como el oxígeno) para elaborar compuestos similares. ¿Por qué es esto así?
En 1864, Julius Lothar Meyer, químico alemán, organizó los elementos por masa atómica y los agrupó según sus propiedades químicas. Posteriormente esa década, Dmitri Mendeleev, químico ruso, organizó todos los elementos conocidos según propiedades similares. Dejó huecos en su mesa por lo que pensaba que eran elementos por descubrir, e hizo algunas predicciones audaces respecto a las propiedades de esos elementos no descubiertos. Cuando más tarde se descubrieron elementos cuyas propiedades coincidían estrechamente con las predicciones de Mendeleev, su versión de la tabla ganó favor en la comunidad científica. Debido a que ciertas propiedades de los elementos se repiten de manera regular a lo largo de la tabla (es decir, son periódicas), se conoció como la tabla periódica.
Mendeleev tuvo que enumerar algunos elementos fuera del orden de sus masas atómicas para agruparlos con otros elementos que tuvieran propiedades similares.
La tabla periódica es una de las piedras angulares de la química porque organiza todos los elementos conocidos en función de sus propiedades químicas. Una versión moderna se muestra en la Figura\(\PageIndex{1}\). La mayoría de las tablas periódicas proporcionan datos adicionales (como la masa atómica) en un cuadro que contiene el símbolo de cada elemento. Los elementos se listan en orden de número atómico.
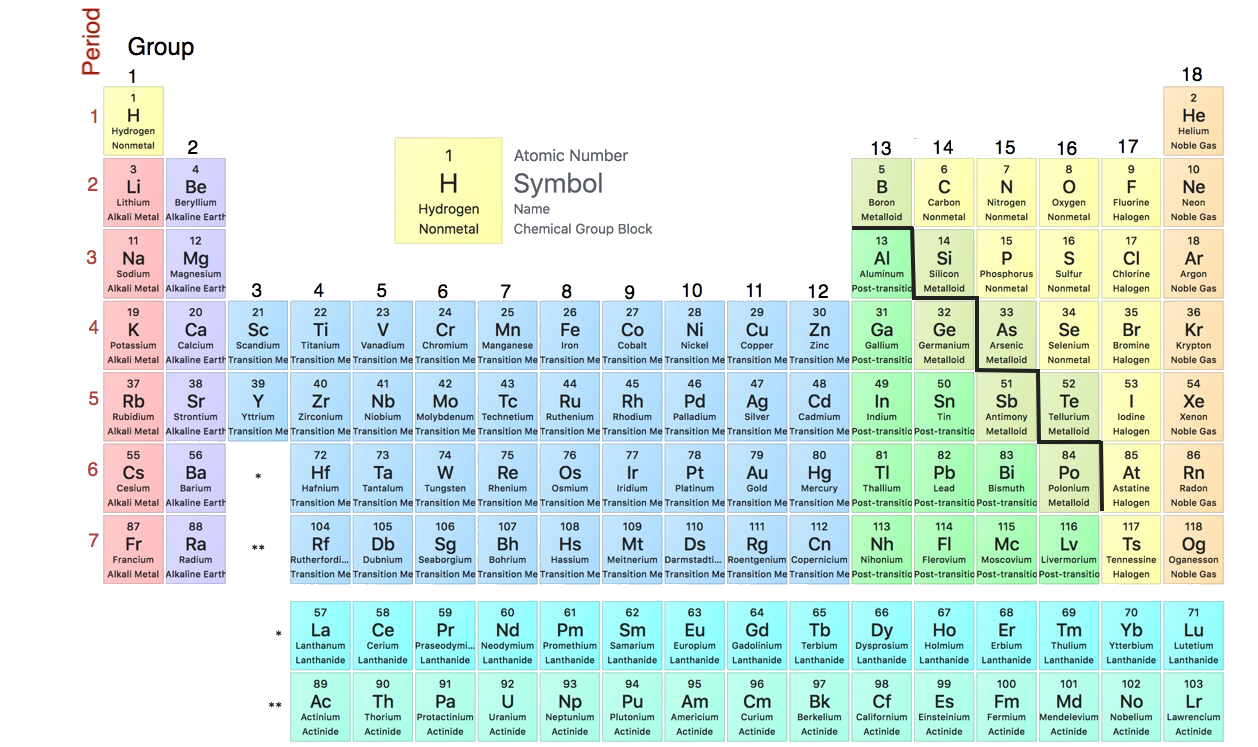
Los elementos que tienen propiedades químicas similares se agrupan en columnas llamadas grupos (o familias). Además de estar numerados, algunos de estos grupos tienen nombres, por ejemplo, metales alcalinos (la primera columna de elementos), metales alcalinotérreos (la segunda columna de elementos), halógenos (la última columna de elementos) y gases nobles (la última columna de elementos).
Cada fila de elementos en la tabla periódica se denomina punto. Los periodos tienen diferentes longitudes; el primer periodo tiene sólo 2 elementos (hidrógeno y helio), mientras que el segundo y tercer período tienen 8 elementos cada uno. El cuarto y quinto periodos tienen 18 elementos cada uno, y los periodos posteriores son tan largos que se retira un segmento de cada uno y se coloca debajo del cuerpo principal de la mesa.
Metales, no metales y metaloides
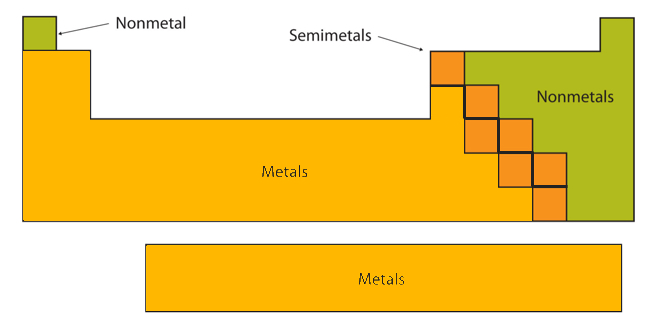
Ciertas propiedades elementales se hacen evidentes en un levantamiento de la tabla periódica en su conjunto. Cada elemento puede clasificarse como un metal, un no metal o un semimetal, como se muestra en la Figura\(\PageIndex{2}\). Un metal es una sustancia que es brillante, típicamente (pero no siempre) de color plateado, y un excelente conductor de electricidad y calor. Los metales también son maleables (pueden ser batidos en láminas delgadas) y dúctiles (se pueden dibujar en alambres delgados). Un no metal es típicamente opaco y un mal conductor de electricidad y calor. Los no metales sólidos también son muy quebradizos. Como se muestra en la Figura\(\PageIndex{2}\), los metales ocupan las tres cuartas partes izquierdas de la tabla periódica, mientras que los no metales (excepto hidrógeno) se agrupan en la esquina superior derecha de la tabla periódica. Los elementos con propiedades intermedias entre los de metales y no metales se denominan semimetales (o metaloides). Los elementos adyacentes a la línea en zigzag en negrita en la porción derecha de la tabla periódica tienen propiedades semimetales.
Ejemplo\(\PageIndex{1}\)
Con base en su posición en la tabla periódica, clasifique cada elemento a continuación como metal, un no metal o un metaloide.
- Se
- Mg
- Ge
Solución
- El número atómico de selenio es 34, lo que lo ubica en el periodo 4 y el grupo 16. En la Figura\(\PageIndex{2}\), el selenio se encuentra arriba y a la derecha de la línea diagonal marcando el límite entre metales y no metales, por lo que debe ser un no metal. Obsérvese, sin embargo, que debido a que el selenio está cerca de la línea divisoria metal-no metálica, no sería sorprendente que el selenio fuera similar a un semimetal en algunas de sus propiedades.
- El magnesio se encuentra a la izquierda de la línea diagonal marcando el límite entre metales y no metales, por lo que debe ser un metal.
- El germanio se encuentra dentro de la línea diagonal que marca el límite entre metales y no metales, por lo que debe ser un metaloide.
Ejercicio\(\PageIndex{1}\)
Con base en su ubicación en la tabla periódica, ¿espera que el indio (In) sea un no metal, un metal o un semimetal?
- Contestar
-
metal
Representante, transición y transición interna
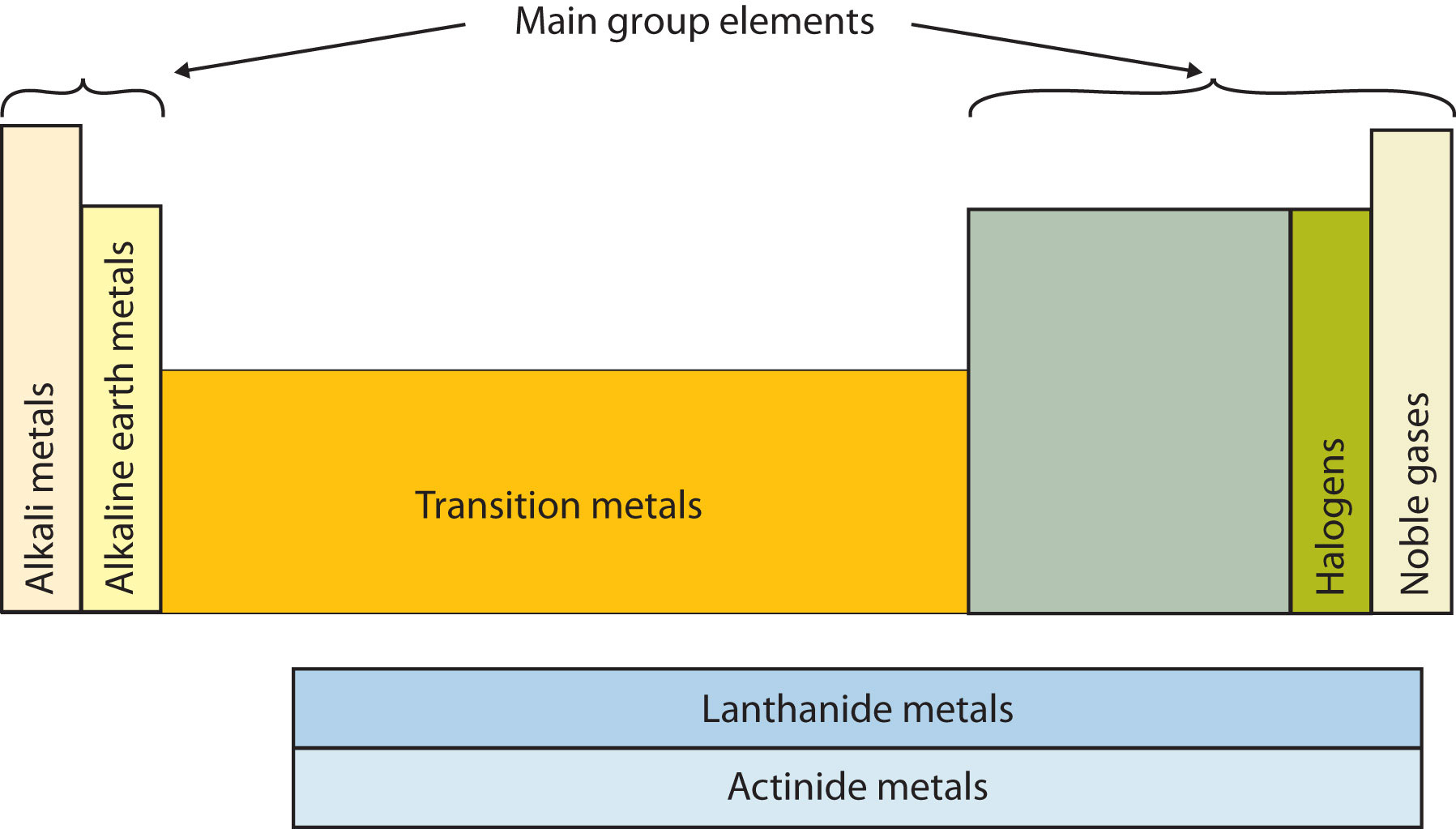
Otra forma de categorizar los elementos de la tabla periódica se muestra en la Figura\(\PageIndex{3}\). Las dos primeras columnas de la izquierda (grupos 1 y 2) y las últimas seis columnas a la derecha (grupos 13-19) se denominan el grupo principal o elementos representativos. El bloque de diez columnas entre estas columnas (grupos 3-12) contiene los metales de transición. Las dos filas debajo del cuerpo principal de la tabla periódica contienen los metales de transición internos. Los elementos en estas dos filas también se conocen como, respectivamente, los metales lantánidos y los metales actínidos.
A Su Salud: Metales de Transición en el Cuerpo
La mayor parte de la composición elemental del cuerpo humano consiste en elementos del grupo principal. El elemento del grupo no principal más abundante es el hierro, al 0.006 por ciento en masa. Debido a que el hierro tiene átomos relativamente masivos, parecería aún más bajo en una lista organizada en términos de porcentaje por átomos en lugar de por ciento en masa.
El hierro es un metal de transición y la química del hierro lo convierte en un componente clave en el correcto funcionamiento de los glóbulos rojos.
Los glóbulos rojos son células que transportan oxígeno de los pulmones a las células del cuerpo y luego transportan dióxido de carbono de las células a los pulmones. Sin glóbulos rojos, la respiración animal tal como la conocemos no existiría. La parte crítica del glóbulo rojo es una proteína llamada hemoglobina. La hemoglobina se combina con oxígeno y dióxido de carbono, transportando estos gases de un lugar a otro en el cuerpo. La hemoglobina es una molécula relativamente grande, con una masa de aproximadamente 65,000 u.
El átomo crucial en la proteína hemoglobina es el hierro. Cada molécula de hemoglobina tiene cuatro átomos de hierro, que actúan como sitios de unión para el oxígeno. Es la presencia de este particular metal de transición en tus glóbulos rojos lo que te permite usar el oxígeno que inhalas.
Otros metales de transición tienen funciones importantes en el organismo, a pesar de estar presentes en cantidades bajas. El zinc es necesario para que el sistema inmunológico del cuerpo funcione correctamente, así como para la síntesis de proteínas y el crecimiento de tejidos y células. El cobre también es necesario para que varias proteínas funcionen correctamente en el cuerpo. El manganeso es necesario para que el cuerpo metabolice el oxígeno de manera adecuada. El cobalto es un componente necesario de la vitamina B-12, un nutriente vital. Estos tres últimos metales están presentes en el cuerpo en cantidades muy pequeñas. Sin embargo, incluso estas pequeñas cantidades son necesarias para que el cuerpo funcione correctamente.

