2.5: Algunas características de diferentes grupos
- Page ID
- 73376
Objetivos de aprendizaje
- Describir cómo algunas características de los elementos se relacionan con sus posiciones en la tabla periódica.
La tabla periódica es útil para comprender las propiedades atómicas que muestran tendencias periódicas. Las tendencias periódicas son patrones específicos que están presentes en la tabla periódica que ilustran diferentes aspectos de un determinado elemento, incluyendo su tamaño y sus propiedades electrónicas. Las principales tendencias periódicas incluyen el radio atómico, el punto de fusión, entre muchas otras propiedades como discutiremos. Las tendencias periódicas, derivadas de la disposición de la tabla periódica, proporcionan a los químicos una herramienta invaluable para predecir rápidamente las propiedades de un elemento. Estas tendencias existen por la similar estructura atómica de los elementos dentro de sus respectivas familias o periodos de grupo, y por la naturaleza periódica de los elementos.
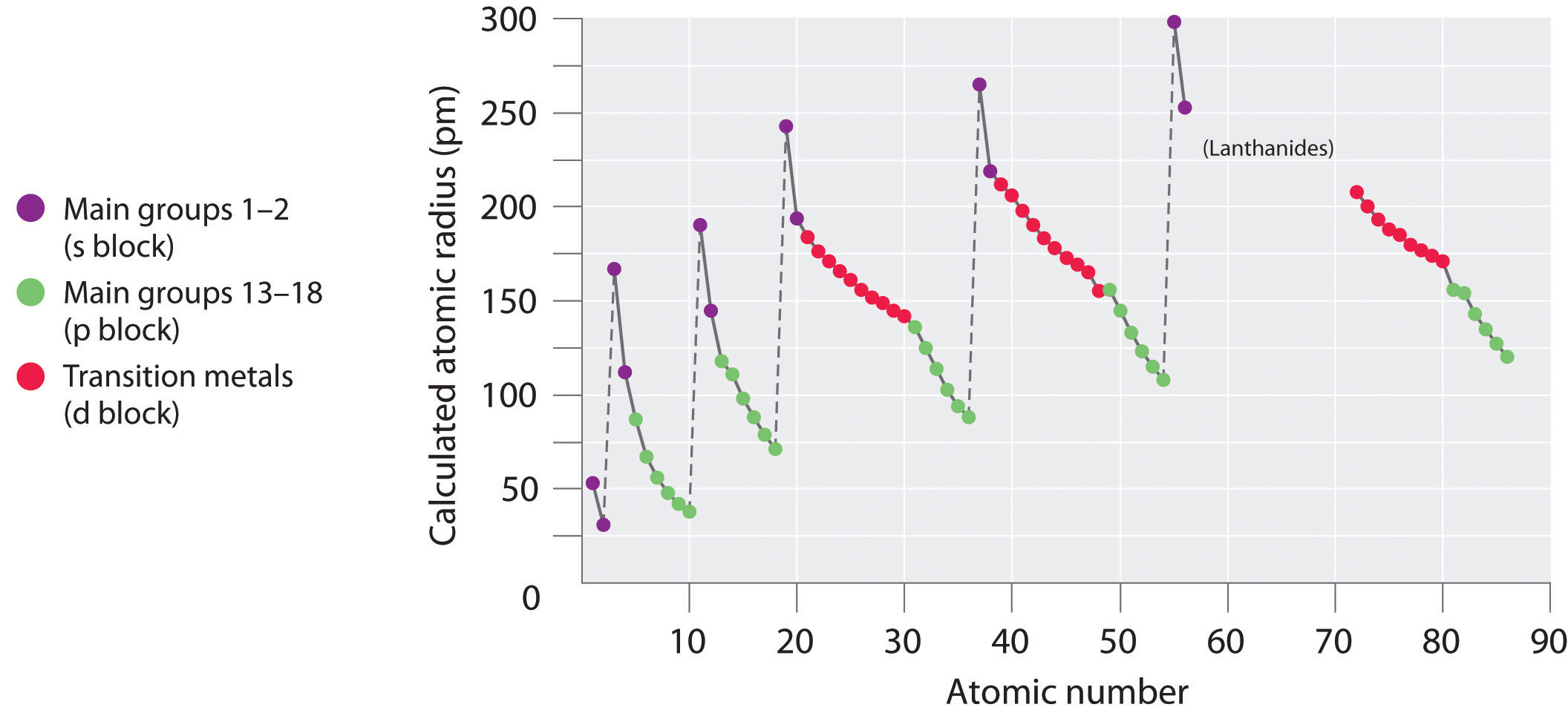
Una propiedad atómica importante es el radio atómico, que es una medida del tamaño atómico, generalmente la distancia desde el núcleo hasta la capa externa del electrón. Sin embargo, dado que este límite no está bien definido, existen múltiples definiciones de radio atómico. Independientemente de la definición utilizada, se puede observar una clara tendencia periódica cuando se traza el radio atómico frente al número atómico (Figura\(\PageIndex{1}\)). Los radios generalmente disminuyen a lo largo de cada fila de la tabla y aumentan hacia abajo en cada grupo. El radio aumenta bruscamente entre el gas noble al final de cada periodo y el metal alcalino al inicio del siguiente periodo. Los átomos más grandes se encuentran en la esquina inferior izquierda de la tabla periódica y los más pequeños se encuentran en la esquina superior derecha
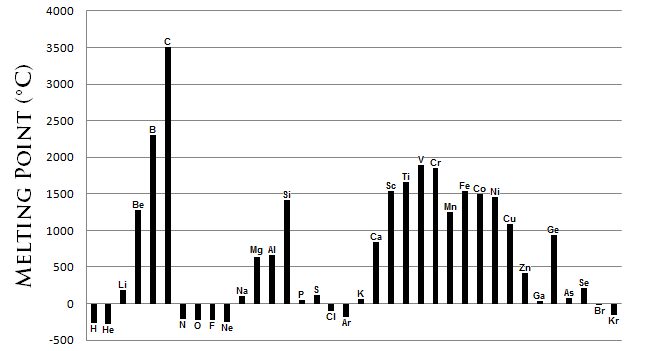
El punto de fusión es una métrica de la energía requerida para transformar la fase sólida de una sustancia en un líquido. Generalmente, cuanto más fuerte es el enlace entre los átomos de un elemento, más energía se requiere para romper ese enlace. Los puntos de fusión presentan tendencias periódicas comparables, aunque más complejas, como se observa en los radios atómicos (Figura\(\PageIndex{2}\)). Las características clave de estas tendencias son:
- Los metales generalmente poseen un alto punto de fusión.
- La mayoría de los no metales poseen puntos de fusión bajos.
- El carbono no metálico posee el punto de fusión más alto de todos los elementos. El boro semimetálico también posee un alto punto de fusión.
Las tendencias de los radios atómicos y puntos de fusión (y otras propiedades químicas y físicas de los elementos) pueden explicarse por la teoría de la capa de electrones del átomo discutida en las siguientes secciones.
Características del elemento por grupo
La tabla periódica se organiza de manera que los elementos con comportamientos químicos similares estén en el mismo grupo. Los químicos suelen hacer declaraciones generales sobre las propiedades de los elementos en un grupo utilizando nombres descriptivos con orígenes históricos. Por ejemplo, los elementos del Grupo 1 se conocen como los metales alcalinos, el Grupo 2 son los metales alcalinotérreos, el Grupo 17 son los halógenos y el Grupo 18 son los gases nobles.
- Grupo 1: Los Metales Alcalinos — litio (Li), sodio (Na), potasio (K), rubidio (Rb), cesio (Cs) y francio (Fr) son metales blandos, brillantes y altamente reactivos. Los compuestos de los metales alcalinos son comunes en la naturaleza y en la vida cotidiana. Un ejemplo es la sal de mesa (cloruro de sodio); los compuestos de litio se utilizan en grasas, en baterías y como medicamentos para tratar a pacientes que presentan comportamiento maníaco-depresivo o bipolar. Aunque el litio, el rubidio y el cesio son relativamente raros en la naturaleza, y el francio es tan inestable y altamente radiactivo que solo existe en pequeñas cantidades, el sodio y el potasio son los séptimo y octavo elementos más abundantes en la corteza terrestre, respectivamente. El hidrógeno es único ya que generalmente se coloca en el Grupo 1, pero no es un metal.
- Grupo 2: Los Metales Alcalinotérreos — berilio (Be), magnesio (Mg), calcio (Ca), estroncio (Sr), bario (Ba) y radio (Ra) son metales brillantes, de color blanco plateado, algo reactivos. El berilio, el estroncio y el bario son raros, y el radio es inestable y altamente radiactivo. En contraste, el calcio y el magnesio son el quinto y sexto elementos más abundantes en la Tierra, respectivamente; se encuentran en enormes yacimientos de piedra caliza y otros minerales.
- Grupo 17: Los halógenos —flúor (F), cloro (Cl), bromo (Br), yodo (I) y astatina (At) son no metales. El nombre halógeno se deriva de las palabras griegas para “formación de sal”, lo que refleja que todos los halógenos reaccionan fácilmente con los metales para formar compuestos, como el cloruro de sodio y el cloruro de calcio (utilizados en algunas áreas como sal de carretera).
- Grupo 18: Los Gases Noble —helio (He), neón (Ne), argón (Ar), criptón (Kr), xenón (Xe) y radón (Rn) son gases a temperatura y presión ambiente. Debido a que los gases nobles están compuestos de solo átomos individuales, se les llama monatómicos. Por su falta de reactividad, durante muchos años se les llamó gases inertes o gases raros. Sin embargo, los primeros compuestos químicos que contenían los gases nobles se prepararon en 1962. Aunque los gases nobles son constituyentes relativamente menores de la atmósfera, el gas natural contiene cantidades sustanciales de helio. Debido a su baja reactividad, el argón se utiliza a menudo como una atmósfera no reactiva (inerte) para soldadura y en bombillas. La luz roja emitida por el neón en un tubo de descarga de gas se utiliza en las luces de neón.
A Tu Salud: Radón
El radón es un gas noble invisible e inodoro que se libera lentamente del suelo, particularmente de rocas y suelos cuyo contenido de uranio es alto. Debido a que es un gas noble, el radón no es químicamente reactivo. Desafortunadamente, es radiactivo, y el aumento de la exposición al mismo se ha correlacionado con un mayor riesgo de cáncer de pulmón.
Debido a que el radón viene del suelo, no podemos evitarlo por completo. Además, debido a que es más denso que el aire, el radón tiende a acumularse en los sótanos, lo que si se ventila incorrectamente puede ser peligroso para los habitantes de un edificio. Afortunadamente, la ventilación especializada minimiza la cantidad de radón que podría acumularse. Hay disponibles sistemas especiales de ventilador y ventilación que extraen aire desde debajo del piso del sótano, antes de que pueda ingresar al espacio habitable y ventilarlo por encima del techo de una casa.
Después de fumar, se cree que el radón es la segunda causa prevenible de cáncer de pulmón en Estados Unidos. La Sociedad Americana del Cáncer estima que el 10% de todos los cánceres de pulmón están relacionados con la exposición al radón. Existe incertidumbre respecto a qué niveles de exposición causan cáncer, así como cuál podría ser el agente causal exacto (ya sea radón o uno de sus productos de descomposición, muchos de los cuales también son radiactivos y, a diferencia del radón, no gases). La Agencia de Protección Ambiental de Estados Unidos recomienda probar cada piso debajo del tercer piso para detectar niveles de radón para protegerse contra los efectos a largo plazo en la salud.
Ejemplo\(\PageIndex{1}\): Grupos
Proporcione los nombres de familia/grupo y los números de período (valores horizontales) de cada elemento.
- Li
- Ar
- Ra
Solución:
- El litio es un metal alcalino. Se ubica en el periodo dos.
- El argón es un gas noble. Se ubica en el periodo tres.
- El radio es un metal alcalino. Se ubica en el periodo siete.
Ejemplo\(\PageIndex{2}\): Clasificación de elementos
Proporcione nombres elementales para las siguientes combinaciones:
- El metal alcalino en el periodo tres.
- El halógeno en el periodo dos
- Un metaloide en el periodo cuatro
- Un metal de transición en el tercer periodo
Solución:
- Sodio
- Flúor
- Germanio o arsénico
- No hay metales de transición en el periodo tres (¡gotcha!)
Claves para llevar
- Los elementos químicos están dispuestos en un gráfico llamado tabla periódica.
- Algunas características de los elementos están relacionadas con su posición en la tabla periódica.
- El número de electrones de valencia de un elemento puede ser determinado por el número de grupo (columna vertical) en la Tabla Periódica. Los elementos con el mismo número de electrones de valencia tienen propiedades químicas similares.

