3.3: Iones de algunos elementos comunes
- Page ID
- 72882
Objetivos de aprendizaje
- Familiarízate con la carga de algunos iones comunes.
- Utilice la tabla periódica para predecir la carga de iones.
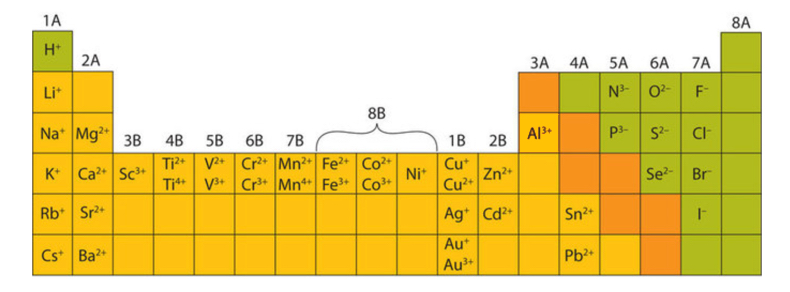
En muchos casos, los elementos que pertenecen al mismo grupo (columna vertical) en la tabla periódica forman iones con la misma carga porque tienen el mismo número de electrones de valencia. Así, como se introdujo anteriormente, la tabla periódica se convierte en una herramienta para recordar las cargas sobre muchos iones. Por ejemplo, todos los iones hechos de metales alcalinos, la primera columna de la tabla periódica, tienen una carga +1. Los iones elaborados a partir de metales alcalinotérreos, el segundo grupo de la tabla periódica, tienen una carga +2. Al otro lado de la tabla periódica, la última columna, los halógenos, forman iones que tienen una carga −1. La figura\(\PageIndex{1}\) muestra cómo se puede predecir la carga en muchos iones por la ubicación de un elemento en la tabla periódica.
Algunos elementos, especialmente los metales de transición, pueden formar iones con cargas variables. La figura\(\PageIndex{1}\) muestra las cargas características de algunos de estos iones. Observe que no existe un patrón simple para los iones de metales de transición (o para los elementos del grupo principal más grande) como lo hay con los iones del grupo principal. Esto se debe a que los metales de transición tienen electrones en la subcapa d y no siguen la regla del octeto. Para que un elemento como el hierro (Fe) logre la misma configuración de gas noble del argón (Ar), necesitaría perder 6 electrones en la subcapa de 3 d y 2 electrones en la subcapa 4s. Un ion hierro con una carga de +8 no es muy probable, por lo tanto, la regla del octeto no es aplicable a los elementos de transición.
Para un ion de carga múltiple, la convención correcta es escribir primero el número de carga seguido del signo. Por ejemplo, el catión de bario está escrito Ba 2 +, no Ba +2.
Ejemplo\(\PageIndex{1}\)
¿Cuál de estos iones no es probable que se forme?
- Mg +
- K +
Solución
(a) El Mg está en el Grupo 2A y tiene dos electrones de valencia. Logra octeto al perder dos electrones para formar el catión Mg 2 +. Perder solo un electrón para formar Mg + no produce un octeto, por lo tanto, no es probable que se forme Mg +.
Ejercicio\(\PageIndex{2}\)
¿Cuál de estos iones no es probable que se forme?
- S 3 −
- N 3 −
- Contestar
-
(a) S está en el Grupo 6A y tiene seis electrones de valencia. Alcanza el octeto al ganar dos electrones para formar anión S2 −. Ganar tres electrones para formar S 3 − no lo convierte en octeto, por lo tanto, S 3 − no es probable que se forme.

