3.4: Propiedades periódicas y formación de iones
- Page ID
- 72855
Objetivos de aprendizaje
- Describir la energía de ionización y la afinidad electrónica y cómo se relaciona con las tendencias de formación de iones.
Hemos visto que los elementos a menudo ganan o pierden suficientes electrones para lograr la configuración de electrones de valencia del gas noble más cercano. ¿Por qué es así? En esta sección, desarrollamos un enfoque más cuantitativo para predecir tales reacciones mediante el examen de tendencias periódicas en los cambios de energía que acompañan a la formación de iones.
Energía de ionización
Debido a que los átomos no pierden electrones espontáneamente, se requiere energía para eliminar un electrón de un átomo para formar un catión. Los químicos definen la energía de ionización (\(IE\)) de un elemento como la cantidad de energía necesaria para eliminar un electrón del átomo gaseoso\(A\) en su estado fundamental. \(IE\)es por lo tanto la energía requerida para la reacción:
\[ A(g) \rightarrow A^+(g) + e^- \;\;\ \text{energy required=IE } \label{3.4.1}\]
Debido a que se requiere una entrada de energía, la energía de ionización siempre es positiva (\(IE > 0\)) para la reacción como está escrito en la Ecuación\(\PageIndex{1}\). Valores mayores de (\(IE\)) significan que el electrón está más estrechamente unido al átomo y por lo tanto, más difícil de eliminar. Las unidades típicas para las energías de ionización son kilojoules/mol (kJ/mol) o electrón voltios (eV):
\[1\; eV / atom = 96.49\; kJ/mol\]
A medida que se mueve a través de una fila en la tabla periódica, las energías de ionización generalmente tienden a aumentar. Esto significa que los elementos del lado izquierdo de la tabla periódica pierden electrones más fácilmente (requiere menos energía para eliminar un electrón) que los del lado derecho de la tabla periódica. La tendencia en la energía de ionización puede explicarse considerando la tendencia en el radio atómico (explicada en un capítulo anterior). A medida que se mueve de izquierda a derecha en la tabla periódica, el tamaño atómico disminuye y las interacciones electrostáticas entre el núcleo y los electrones de valencia aumentan, lo que aumenta la energía requerida para eliminar los electrones, así el (\(IE\)) aumenta.
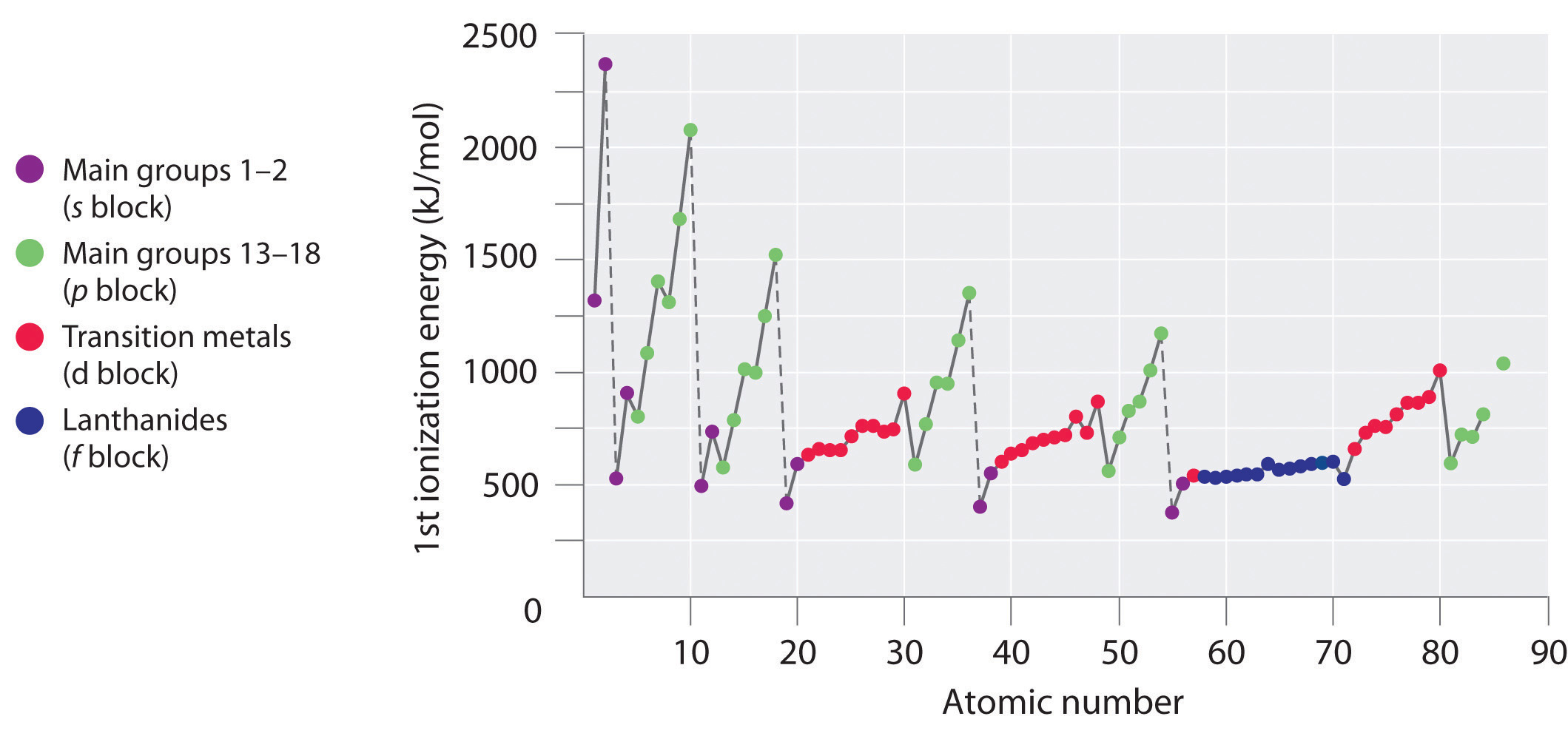
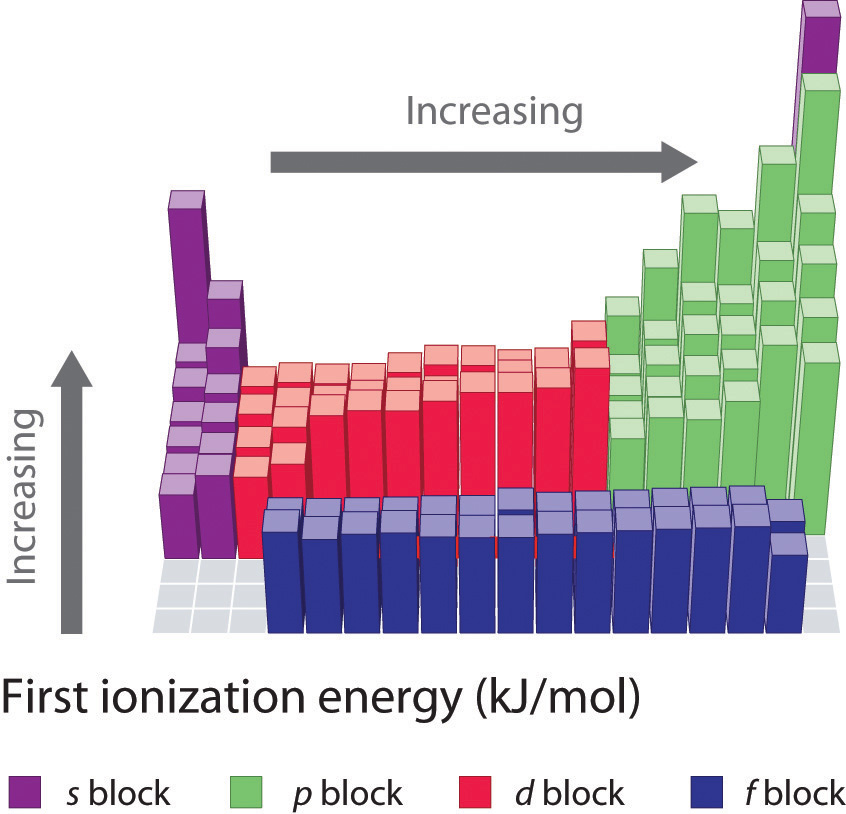
Si miras de cerca las tendencias en la energía de ionización, notarás que hay algunas “excepciones” en las que ves una disminución de la energía en lugar de un aumento. En los periodos 1 y 2, se puede ver esta disminución en (\(IE\)) entre los grupos 2 y 3 y nuevamente entre los grupos 5 y 6. Estas variaciones en la tendencia pueden explicarse más a fondo observando de cerca las configuraciones de electrones de los átomos en cuestión. A medida que pasa del magnesio al aluminio, se agrega un electrón a la subcapa de 3 p. Este electrón de 3 p está ligeramente más alejado del núcleo (mayor en energía) y por lo tanto, es más fácil de eliminar en comparación con los electrones de 3 s. La disminución entre fósforo y azufre ocurre porque el electrón agregado en el azufre es el primero en ser emparejado en la subcapa p. Estos dos electrones en el mismo orbital p se repelen entre sí, haciendo que el átomo de azufre sea ligeramente menos estable de lo que de otro modo se esperaría, como es cierto para todos los elementos del grupo 16. Este electrón es más fácil de eliminar porque conducirá a una mayor estabilidad.
Ejemplo\(\PageIndex{1}\): La energía más baja de la primera ionización
Utilice sus ubicaciones en la tabla periódica para predecir qué elemento tiene la primera energía de ionización más baja: Ca, K, Mg, Na, Rb o Sr.
Dado: seis elementos
Preguntado por: elemento con menor energía de primera ionización
Estrategia:
Localice los elementos en la tabla periódica. Con base en las tendencias en las energías de ionización a lo largo de una fila y una columna, identificar el elemento con la energía de primera ionización más baja.
Solución:
Estos seis elementos forman un rectángulo en las dos columnas de extrema izquierda de la tabla periódica. Debido a que sabemos que las energías de ionización aumentan de izquierda a derecha en una fila y de abajo a arriba de una columna, podemos predecir que el elemento en la parte inferior izquierda del rectángulo tendrá la energía de ionización más baja de la primera: Rb.
Ejercicio\(\PageIndex{1}\): La energía de ionización más alta
Utilice sus ubicaciones en la tabla periódica para predecir qué elemento tiene la energía de primera ionización más alta: As, Bi, Ge, Pb, Sb o Sn.
- Contestar
-
\(\ce{As}\)
Afinidad de electrones
La afinidad electrónica (\(EA\)) de un elemento\(A\) se define como el cambio de energía que ocurre cuando se agrega un electrón a un átomo o ion gaseoso:
\[ A(g)+e^- \rightarrow A^-(g) \;\;\; \text{energy change=}EA \label{7.5.1}\]
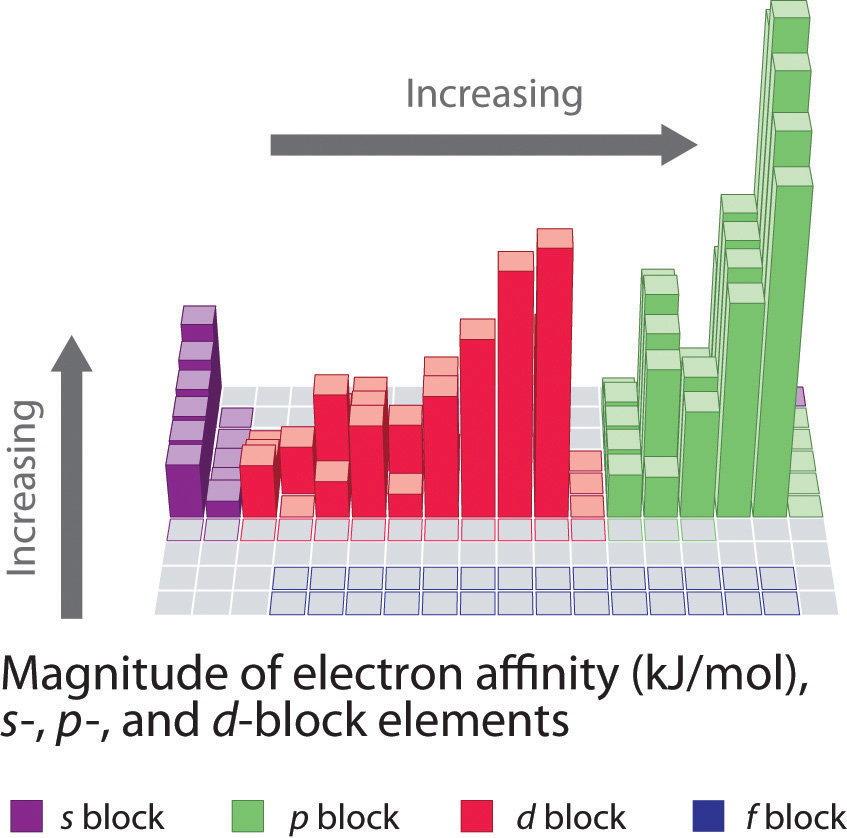
A diferencia de las energías de ionización, que siempre son positivas para un átomo neutro porque se requiere energía para eliminar un electrón, las afinidades de los electrones pueden ser negativas (la energía se libera cuando se agrega un electrón), positiva (la energía debe agregarse al sistema para producir un anión), o cero (el proceso es energéticamente neutral). Esta convención de signos es consistente con un valor negativo correspondiente al cambio de energía para un proceso exotérmico, que es aquel en el que se libera calor (Figura\(\PageIndex{2}\)).
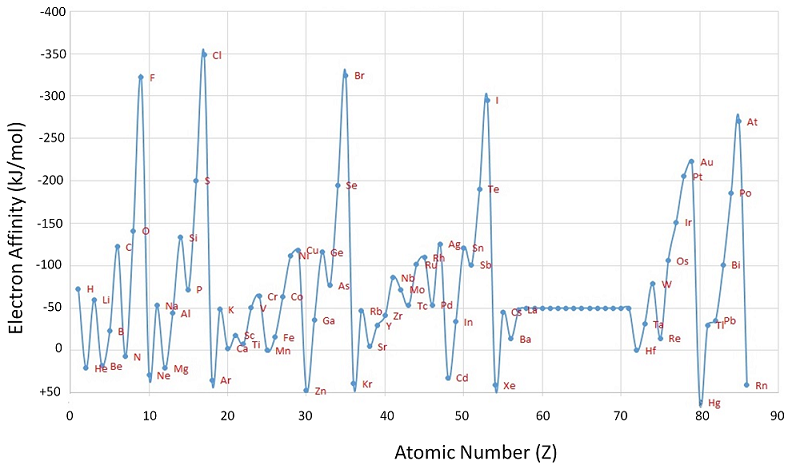
El átomo de cloro tiene la afinidad electrónica más negativa de cualquier elemento, lo que significa que se libera más energía cuando se agrega un electrón a un átomo de cloro gaseoso que a un átomo de cualquier otro elemento:
\[ \ce{ Cl(g) + e^- \rightarrow Cl^- (g)} \;\;\; EA=-346\; kJ/mol \label{7.5.2}\]
Por el contrario, el berilio no forma un anión estable, por lo que su afinidad electrónica efectiva es
\[ \ce{ Be(g) + e^- \rightarrow Be^- (g)} \;\;\; EA \ge 0 \label{7.5.3}\]
En general, las afinidades de electrones de los elementos del grupo principal se vuelven menos negativas a medida que avanzamos por una columna. Esto se debe a que a medida que aumenta el nivel de energía, los electrones adicionales ingresan a orbitales que están cada vez más lejos del núcleo, y es menos fácil ganar electrones adicionales formando aniones.
Ejemplo\(\PageIndex{2}\): Afinidades de electrones contrastantes de Sb, Se y Te
Con base en sus posiciones en la tabla periódica, ¿cuál de Sb, Se o Te predeciría que tendría la afinidad electrónica más negativa?
Dado: tres elementos
Preguntado por: elemento con mayor afinidad electrónica negativa
Estrategia:
- Localice los elementos en la tabla periódica. Utilizar las tendencias en afinidades de electrones bajando una columna para elementos del mismo grupo. De igual manera, utilice las tendencias en afinidades de electrones de izquierda a derecha para los elementos de la misma fila.
- Coloque los elementos en orden, enumerando primero el elemento con la afinidad electrónica más negativa.
Solución:
Sabemos que las afinidades de electrones se vuelven menos negativas bajando por una columna (excepto por las afinidades de electrones anómalamente bajas de los elementos de la segunda fila), por lo que podemos predecir que la afinidad electrónica de Se es más negativa que la de Te. También sabemos que las afinidades de los electrones se vuelven más negativas de izquierda a derecha a través de una fila, y que los elementos del grupo 15 tienden a tener valores que son menos negativos de lo esperado. Debido a que Sb se localiza a la izquierda de Te y pertenece al grupo 15, predecimos que la afinidad electrónica de Te es más negativa que la de Sb. El orden general es Se < Te < Sb, por lo que Se tiene la afinidad electrónica más negativa entre los tres elementos.
Ejercicio\(\PageIndex{2}\): Afinidades de electrones contrastantes de Rb, Sr y Xe
Con base en sus posiciones en la tabla periódica, ¿cuál de Rb, Sr o Xe predeciría que probablemente formaría un anión gaseoso?
- Contestar
-
Rb

