6.4: Relaciones de masas y ecuaciones químicas
- Page ID
- 72977
- Convertir de masa o moles de una sustancia a masa o moles de otra sustancia en una reacción química.
Hemos establecido que una ecuación química equilibrada se equilibra tanto en términos de moles como de átomos o moléculas. Hemos utilizado ecuaciones equilibradas para establecer relaciones, ahora en términos de moles de materiales, que podemos usar como factores de conversión para responder preguntas estequiométricas, como cuántos moles de sustancia A reaccionan con tantos moles de reactivo B. Podemos extender aún más esta técnica. Recordemos que podemos relacionar una cantidad molar con una cantidad de masa usando masa molar. Podemos usar esa capacidad para responder preguntas estequiométricas en términos de las masas de una sustancia en particular, además de los moles. Hacemos esto usando la siguiente secuencia:
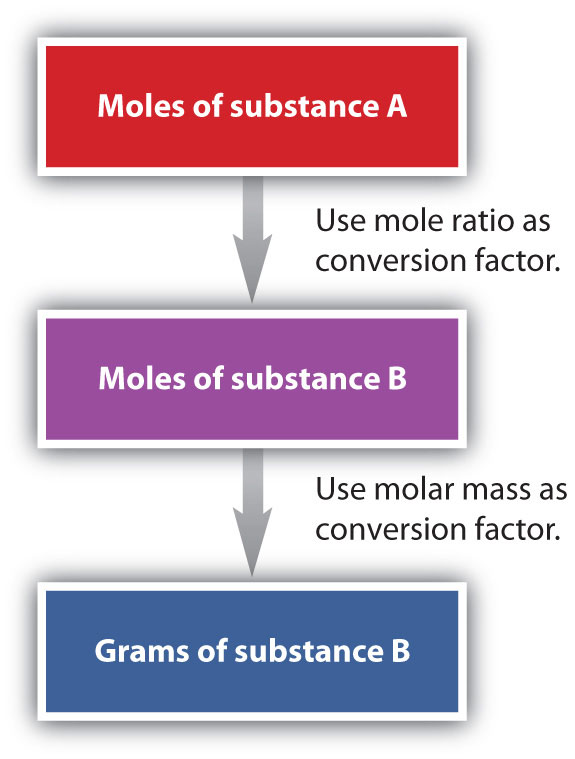
Colectivamente, estas conversiones se denominan cálculos de masa molar.
Como ejemplo, considere la ecuación química equilibrada
\[\ce{Fe_2O_3 + 3SO_3 \rightarrow Fe_2(SO_4)_3} \nonumber \nonumber \]
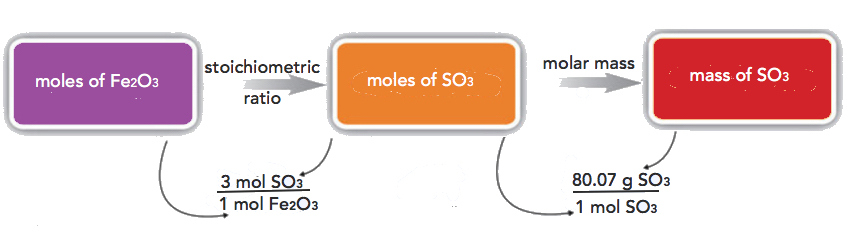
Si tenemos 3.59 mol de Fe 2 O 3, ¿cuántos gramos de SO 3 pueden reaccionar con él? Usando la secuencia de cálculo de masa molar, podemos determinar la masa requerida de SO 3 en dos pasos. Primero, construimos la relación molar apropiada, determinada a partir de la ecuación química equilibrada, para calcular el número de moles de SO 3 necesarios. Luego usando la masa molar de SO 3 como factor de conversión, determinamos la masa que tiene este número de moles de SO 3.
El primer paso se asemeja a los ejercicios que hicimos en la Sección 6.4. Como de costumbre, comenzamos con la cantidad que nos dieron:
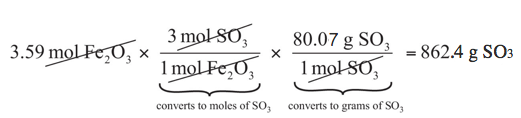
\[\mathrm{3.59\: mol\: Fe_2O_3\times\dfrac{3\: mol\: SO_3}{1\: mol\: Fe_2O_3}=10.77\: mol\: SO_3} \nonumber \nonumber \]
El mol Fe 2 O 3 unidades cancelan, dejando mol SO 3 unidad. Ahora, tomamos esta respuesta y la convertimos a gramos de SO 3, usando la masa molar de SO 3 como factor de conversión:
\[\mathrm{10.77\: mol\: SO_3\times\dfrac{80.07\: g\: SO_3}{1\: mol\: SO_3}=862.4\: g\: SO_3} \nonumber \nonumber \]
Nuestra respuesta final se expresa a tres cifras significativas. Así, en un proceso de dos etapas, encontramos que 862 g de SO 3 reaccionarán con 3.59 mol de Fe 2 O 3. Muchos problemas de este tipo pueden ser respondidos de esta manera.
El mismo problema de dos pasos también se puede resolver en una sola línea, en lugar de como dos pasos separados, de la siguiente manera:
Obtenemos exactamente la misma respuesta al combinar todos los pasos matemáticos juntos como lo hacemos cuando calculamos un paso a la vez.
¿Cuántos gramos de CO 2 se producen si 2.09 mol de HCl reaccionan de acuerdo con esta ecuación química equilibrada?
\[\ce{CaCO_3 + 2HCl \rightarrow CaCl_2 + CO_2 + H_2O} \nonumber \]
Solución
Nuestra estrategia será convertir de moles de HCl a moles de CO 2 y luego de moles de CO 2 a gramos de CO 2. Necesitaremos la masa molar de CO 2, que es 44.01 g/mol. Al realizar estas dos conversiones en una sola línea, se obtienen 46.0 g de CO 2:
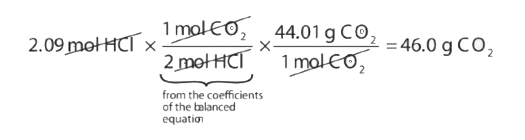
La relación molar entre CO 2 y HCl proviene de la ecuación química equilibrada.
¿Cuántos gramos de glucosa (C 6 H 12 O 6) se producen si 17.3 mol de H 2 O reaccionan de acuerdo con esta ecuación química equilibrada?
\[\ce{6CO_2 + 6H_2O \rightarrow C_6H_{12}O_6 + 6O_2} \nonumber \]
- Contestar
-
\(\mathrm{17.3\: mol\: H_2O\times\dfrac{1\: mol\: C_6H_{12}O_6}{6\: mol\: H_2O}\times\dfrac{180.18\: g\: C_6H_{12}O_6}{1\: mol\: C_6H_{12}O_6}=520\: g\: C_6H_{12}O_6}\)
Es un pequeño paso desde los cálculos de masa molar hasta los cálculos de masa y masa. Si comenzamos con una masa conocida de una sustancia en una reacción química (en lugar de un número conocido de moles), podemos calcular las masas correspondientes de otras sustancias en la reacción. El primer paso en este caso es convertir la masa conocida en moles, utilizando la masa molar de la sustancia como factor de conversión. Entonces, y solo entonces, usamos la ecuación química balanceada para construir un factor de conversión para convertir esa cantidad en moles de otra sustancia, que a su vez se puede convertir en una masa correspondiente. Secuencialmente, el proceso es el siguiente:
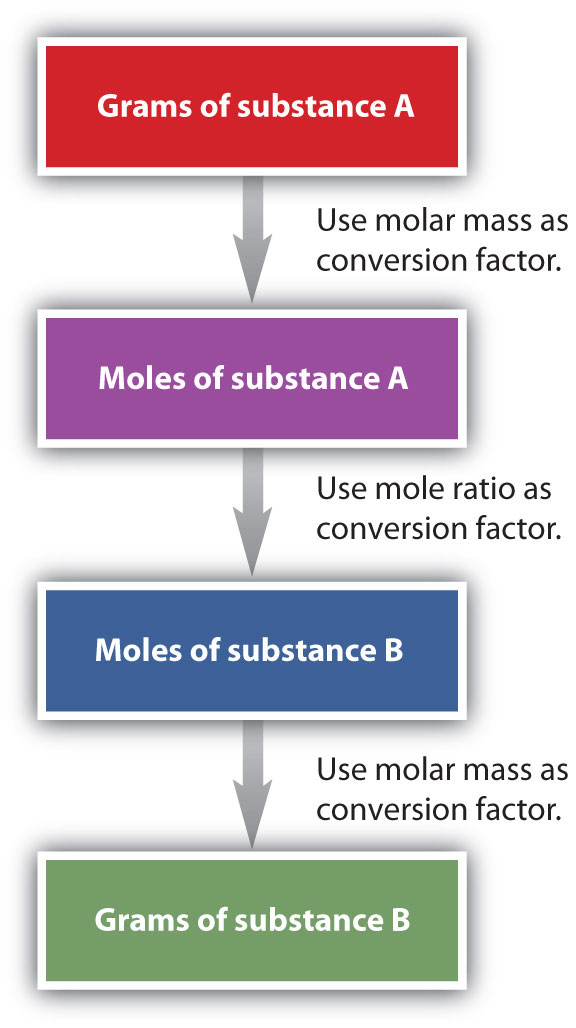
Este proceso de tres partes se puede llevar a cabo en tres etapas discretas o combinarse en un solo cálculo que contiene tres factores de conversión. El siguiente ejemplo ilustra ambas técnicas.
El metano puede reaccionar con el cloro elemental para producir tetracloruro de carbono (\(\ce{CCl4}\)). La ecuación química equilibrada es la siguiente:
\[\ce{CH_4 + 4Cl_2 \rightarrow CCl_4 + 4HCl} \nonumber \]
¿Cuántos gramos de HCl se producen por la reacción de 100.0 g de\(\ce{CCl4}\)?
Solución
Primero, trabajemos el problema de manera escalonada. Comenzamos convirtiendo la masa de\(\ce{CCl4}\) a moles de\(\ce{CCl4}\), utilizando la masa molar de\(\ce{CCl4}\) (16.05 g/mol) como factor de conversión:
\(\mathrm{100.0\: g\: CH_4\times\dfrac{1\: mol\: CH_4}{16.05\: g\: CH_4}=6.231\: mol\: CH_4}\)
Tenga en cuenta que invertimos la masa molar para que las unidades gram cancelen, dándonos una respuesta en moles. A continuación, utilizamos la ecuación química equilibrada para determinar la relación de moles\(\ce{CCl4}\) y moles de HCl y convertir nuestro primer resultado en moles de HCl:
\(\mathrm{6.231\: mol\: CH_4\times\dfrac{4\: mol\: HCl}{1\: mol\: CH_4}=24.92\: mol\: HCl}\)
Finalmente, se utiliza la masa molar de HCl (36.46 g/mol) como factor de conversión para calcular la masa de 24.92 mol de HCl:
\(\mathrm{24.92\: mol\: HCl\times\dfrac{36.46\: g\: HCl}{1\: mol\: HCl}=908.5\: g\: HCl}\)
En cada paso, hemos limitado la respuesta al número adecuado de cifras significativas. Si lo desea, podemos hacer las tres conversiones en una sola línea:
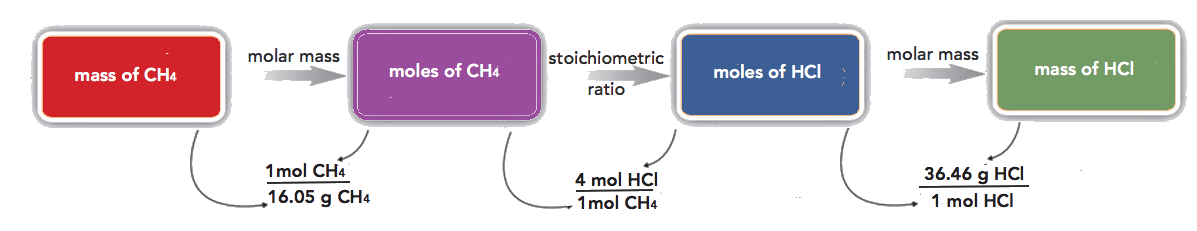
\(\mathrm{100.0\: g\: CH_4\times\dfrac{1\: mol\: CH_4}{16.05\: g\: CH_4}\times\dfrac{4\: mol\: HCl}{1\: mol\: CH_4}\times\dfrac{36.46\: g\: HCl}{1\: mol\: HCl}=908.7\: g\: HCl}\)
Esta respuesta final es ligeramente diferente de nuestra primera respuesta porque solo la respuesta final se restringe al número adecuado de cifras significativas. En la primera respuesta, limitamos cada cantidad intermedia al número adecuado de cifras significativas. Como puede ver, ambas respuestas son esencialmente las mismas.
La oxidación del propanal (CH 3 CH 2 CHO) a ácido propiónico (CH 3 CH 2 COOH) tiene la siguiente ecuación química:
CH 3 CH 2 CHO + 2K 2 Cr 2 O 7 → CH 3 CH 2 COOH + otros productos
¿Cuántos gramos de ácido propiónico se producen por la reacción de 135.8 g de K 2 Cr 2 O 7?
- Contestar
-
\(\mathrm{135.8\: g\: K_2Cr_2O_7\times\dfrac{1\: mol\: K_2Cr_2O_7}{294.20\: g\: K_2Cr_2O_7}\times\dfrac{1\: mol\: CH_3CH_2COOH}{2\: mol\: K_2Cr_2O_7}\times\dfrac{74.09\: g\: CH_3CH_2COOH}{1\: mol\: CH_3CH_2COOH}=17.10\: g\: CH_3CH_2COOH}\)
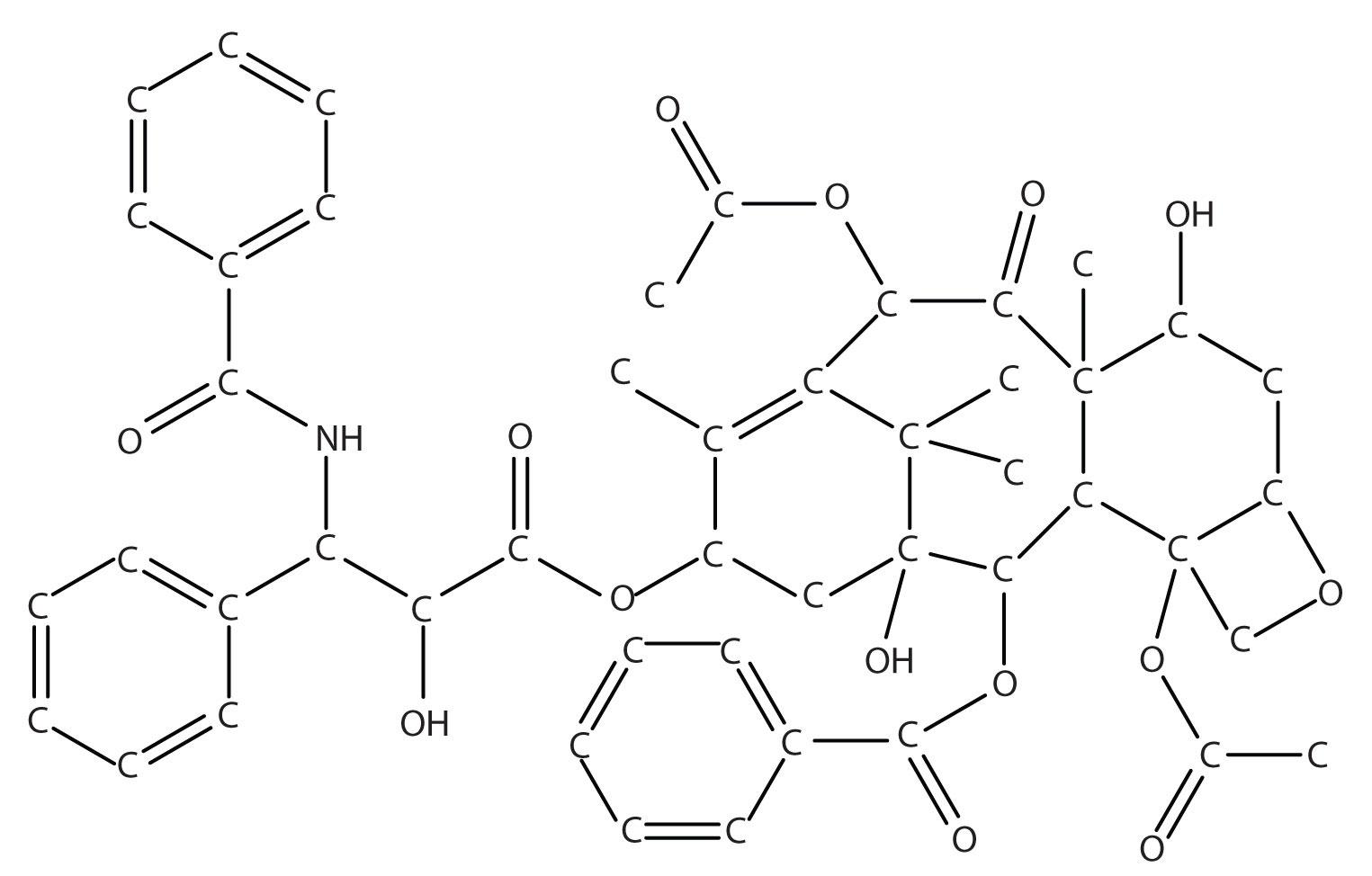
El taxol es un potente fármaco anticancerígeno que se extrajo originalmente del tejo del Pacífico (Taxus brevifolia). Como se puede apreciar en la figura que lo acompaña, el taxol es una molécula muy complicada, con una fórmula molecular de\(\ce{C47H51NO14}\). El aislamiento del taxol de su fuente natural presenta ciertos desafíos, principalmente que el tejo del Pacífico es un árbol de crecimiento lento, y se debe cosechar el equivalente a seis árboles para proporcionar suficiente taxol para tratar a un solo paciente. Aunque las especies relacionadas de tejos también producen taxol en pequeñas cantidades, existe un interés significativo en sintetizar esta compleja molécula en el laboratorio.
Después de un esfuerzo de 20 años, dos grupos de investigación anunciaron la síntesis completa de laboratorio del taxol en 1994. Sin embargo, cada síntesis requirió más de 30 reacciones químicas separadas, con una eficiencia global de menos de 0.05%. Para poner esto en perspectiva, para obtener una dosis única de 300 mg de taxol, se tendría que comenzar con 600 g de material de partida. Para tratar a las 26 mil mujeres a las que se les diagnostica cáncer de ovario cada año con una sola dosis, casi 16,000 kg (más de 17 toneladas) de material de partida deben convertirse en taxol. El taxol también se usa para tratar el cáncer de mama, con el que cada año se diagnostica a 200,000 mujeres en Estados Unidos. Esto solo aumenta la cantidad de material de partida necesario.
Claramente, existe un intenso interés en aumentar la eficiencia general de la síntesis de taxol. Una síntesis mejorada no sólo será más fácil sino que también producirá menos materiales de desecho, lo que permitirá que más personas aprovechen este medicamento potencialmente salvavidas.
Llave para llevar
- Una ecuación química equilibrada puede ser utilizada para relacionar masas o moles de diferentes sustancias en una reacción.

