6.3: Relaciones lunares y ecuaciones químicas
- Page ID
- 72965
- Utilizar una reacción química equilibrada para determinar las relaciones molares entre las sustancias.
Anteriormente, aprendiste a equilibrar las ecuaciones químicas comparando los números de cada tipo de átomo en los reactivos y productos. Los coeficientes frente a las fórmulas químicas representan el número de moléculas o unidades de fórmula (dependiendo del tipo de sustancia). Aquí, extenderemos el significado de los coeficientes en una ecuación química.
Considera la ecuación química simple
\[\ce{2H_2 + O_2 → 2H_2O}\nonumber \]
La convención para escribir ecuaciones químicas balanceadas es usar la relación de número entero más baja para los coeficientes. Sin embargo, la ecuación se equilibra siempre y cuando los coeficientes estén en una relación 2:1:2. Por ejemplo, esta ecuación también se equilibra si la escribimos como
\[\ce{4H_2 + 2O_2 → 4H_2O}\nonumber \]
La relación de los coeficientes es 4:2:4, que se reduce a 2:1:2. La ecuación también se equilibra si la escribiéramos como
\[\ce{22H_2 + 11O_2 → 22H_2O}\nonumber \]
porque 22:11:22 también reduce a 2:1:2.
Supongamos que queremos usar números más grandes. Considera los siguientes coeficientes:
\[12.044 \times 10^{23}\; H_2 + 6.022 \times 10^{23}\; O_2 → 12.044 \times 10^{23}\; H_2O\nonumber \]
Estos coeficientes también tienen la relación 2:1:2 (verifíquelo y vea), por lo que esta ecuación se equilibra. Pero 6.022 × 10 23 es 1 mol, mientras que 12.044 × 10 23 es 2 mol (y el número se escribe de esa manera para que esto sea más obvio), así podemos simplificar esta versión de la ecuación escribiéndola como
\[\ce{2 \;mol\; H_2 + 1\; mol\; O_2 → 2 \;mol\; H_2O}\nonumber \]
Podemos dejar de lado la palabra mol y no escribir el coeficiente 1 (como es nuestro hábito), por lo que la forma final de la ecuación, aún equilibrada, es
\[\ce{2H_2 + O_2 → 2H_2O}\nonumber \]
Ahora interpretamos los coeficientes como referentes a cantidades molares, no a moléculas individuales. ¿La lección? Las ecuaciones químicas balanceadas se equilibran no solo a nivel molecular sino también en términos de cantidades molares de reactivos y productos. Así, podemos leer esta reacción como “dos moles de hidrógeno reaccionan con un mol de oxígeno para producir dos moles de agua”.
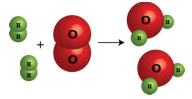
2 moléculas H 2 1 molécula O 2 2 moléculas H 2 O
2 moles H 2 1 mol O 2 moles H 2 O
2 x 2.02 g=4.04 g H 2 32.0 g O 2 2 x 18.02 g=36.04 g H 2 O
Figura\(\PageIndex{1}\): Esta representación de la producción de agua a partir de oxígeno e hidrógeno muestra varias formas de interpretar la información cuantitativa de una reacción química.
De la misma manera, las proporciones que construimos para describir la reacción de las moléculas también se pueden construir en términos de moles en lugar de moléculas. Para la reacción en la que se combinan hidrógeno y oxígeno para hacer agua, por ejemplo, podemos construir las siguientes proporciones:
\[\mathrm{\dfrac{2\: mol\: H_2}{1\: mol\: O_2}\: or\: \dfrac{1\: mol\: O_2}{2\: mol\: H_2}}\nonumber \]
\[\mathrm{\dfrac{2\: mol\: H_2O}{1\: mol\: O_2}\: or\: \dfrac{1\: mol\: O_2}{2\: mol\: H_2O}}\nonumber \]
\[\mathrm{\dfrac{2\: mol\: H_2}{2\: mol\: H_2O}\: or\: \dfrac{2\: mol\: H_2O}{2\: mol\: H_2}}\nonumber \]
Podemos usar estas proporciones para determinar qué cantidad de una sustancia, en moles, reaccionará con o producirá un número dado de moles de una sustancia diferente. El estudio de las relaciones numéricas entre los reactivos y los productos en reacciones químicas equilibradas se denomina estequiometría. La relación de coeficientes en una ecuación química equilibrada, utilizada en cálculos que relacionan cantidades de reactivos y productos se denomina factor estequiométrico.
¿Cuántos moles de oxígeno reaccionan con hidrógeno para producir 27.6 mol de H 2 O? La ecuación equilibrada es la siguiente:
\[\ce{2H2 + O2 -> 2H2O} \nonumber \nonumber \]
Solución
Debido a que estamos tratando con cantidades de H 2 O y O 2, usaremos la relación estequiométrica que relaciona esas dos sustancias. Debido a que se nos da una cantidad de H 2 O y queremos determinar una cantidad de O 2, usaremos la relación que tiene H 2 O en el denominador (por lo que cancela) y O 2 en el numerador (por lo que se introduce en la respuesta). Por lo tanto,
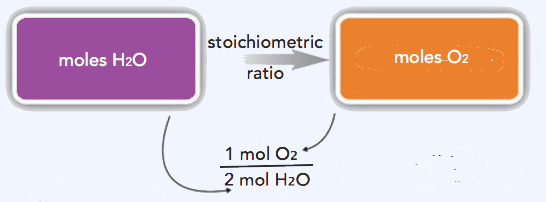
\(\mathrm{27.6\: mol\: H_2O\times\dfrac{1\: mol\: O_2}{2\: mol\: H_2O}=13.8\: mol\: O_2}\)
Para producir 27.6 mol de H 2 O, 13.8 mol de O 2 reaccionan.
Usando 2H 2 + O 2 → 2H 2 O, ¿cuántos moles de hidrógeno reaccionan con 3.07 moles de oxígeno para producir H 2 O?
- Contestar
-
\(\mathrm{3.07\: mol\: O_2\times\dfrac{2\: mol\: H_2}{1\: mol\: O_2}=6.14\: mol\: H_2}\)
Llave para llevar
- La reacción química equilibrada puede ser utilizada para determinar las relaciones molares entre las sustancias.

