9.2: El proceso de solución
- Page ID
- 73238
- Predecir la solubilidad en función de las interacciones entre soluto y disolvente.
¿Qué ocurre a nivel molecular para hacer que un soluto se disuelva en un solvente? La respuesta depende en parte de la fuerza de las atracciones entre las partículas de soluto y disolvente. Una buena regla general es usar es como se disuelve como, lo que significa que las sustancias deben tener fuerzas intermoleculares similares para formar soluciones.
Una sustancia puede disolverse en un disolvente, y formar una solución, si el soluto y el disolvente son atraídos entre sí. Por ejemplo, las moléculas de agua que se mantienen unidas por enlaces de hidrógeno disolverán solutos que también pueden formar enlaces de hidrógeno, como el etanol (CH 3 CH 2 OH). Los nuevos enlaces de hidrógeno entre el agua y las moléculas de etanol (atracciones disolvente-soluto) son casi tan fuertes como los enlaces de hidrógeno en agua (disolvente-disolvente) y etanol (soluto-soluto) solos, lo que hace que el proceso de formación de la solución (también llamado disolución o disolución) sea favorable.
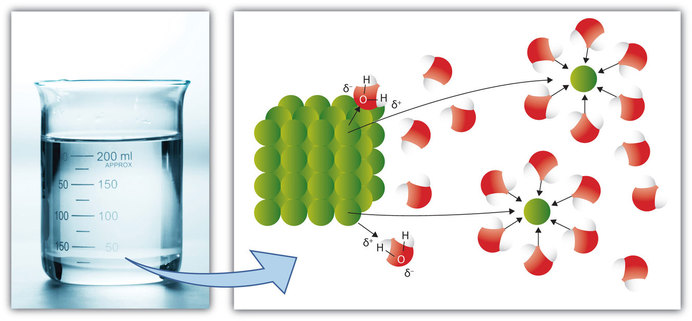
En el caso de un soluto sólido o líquido, las interacciones entre las partículas de soluto y las partículas de disolvente son tan fuertes que las partículas individuales de soluto se separan entre sí y, rodeadas de moléculas de disolvente. (Los solutos gaseosos ya tienen sus partículas constituyentes separadas, pero aún se aplica el concepto de estar rodeados por partículas de disolvente). Este proceso se denomina solvatación y se ilustra en la Figura\(\PageIndex{1}\). Cuando el disolvente es agua, se usa la palabra hidratación, más que solvatación.
Cuando se mezclan un soluto y un disolvente que no tienen fuerzas intermoleculares similares, no se forma una solución porque las atracciones soluto-soluto o disolvente-disolvente son más fuertes que cualquier interacción favorable entre soluto y disolvente. Por ejemplo, cuando se mezclan agua y aceite, permanecerán en capas separadas: las moléculas de agua permanecen unidas por hidrógeno entre sí y las moléculas de aceite permanecen juntas.
Compuestos Iónicos y Compuestos Covalentes como Solutos
En el caso de solutos moleculares como la glucosa, las partículas de soluto son moléculas individuales. Sin embargo, si el soluto es iónico, los iones individuales se separan entre sí y quedan rodeados por partículas de disolvente. Los cationes cargados positivamente son atraídos por el neg y los aniones de un soluto iónico se separan cuando el soluto se disuelve. Este proceso se conoce como disociación (Figura\(\PageIndex{1}\)).
La disociación de compuestos iónicos solubles da a las soluciones de estos compuestos una propiedad interesante: conducen la electricidad. Debido a esta propiedad, los compuestos iónicos solubles se denominan electrolitos. Muchos compuestos iónicos se disocian completamente y por lo tanto se denominan electrolitos fuertes. El cloruro de sodio es un ejemplo de un electrolito fuerte. Algunos compuestos se disuelven pero se disocian solo parcialmente, y las soluciones de tales solutos pueden conducir la electricidad solo débilmente. Estos solutos se denominan electrolitos débiles. El ácido acético (CH 3 COOH), el compuesto en vinagre, es un electrolito débil. Los solutos que se disuelven en moléculas neutras individuales sin disociación no imparten conductividad eléctrica adicional a sus soluciones y se denominan no electrolitos. El azúcar de mesa (C 12 H 22 O 11) es un ejemplo de un no electrolito.
El término electrolito se usa en medicina para referirse a cualquiera de los iones importantes que se disuelven en solución acuosa en el cuerpo. Los electrolitos fisiológicos importantes incluyen Na +, K +, Ca 2 +, Mg 2 + y Cl −.
Todas las siguientes sustancias se disuelven en cierta medida en agua. Clasificar cada uno como un electrolito o un no electrolito.
- cloruro de potasio (KCl)
- fructosa (C 6 H 12 O 6)
- alcohol isopropílico [CH 3 CH (OH) CH 3]
- hidróxido de magnesio [Mg (OH) 2]
Solución
Cada sustancia puede clasificarse como un soluto iónico o un soluto no iónico. Los solutos iónicos son electrolitos y los solutos no iónicos no son electrolitos.
- El cloruro de potasio es un compuesto iónico; por lo tanto, cuando se disuelve, sus iones se separan, convirtiéndolo en un electrolito.
- La fructosa es un azúcar similar a la glucosa. (De hecho, tiene la misma fórmula molecular que la glucosa.) Debido a que es un compuesto molecular, esperamos que sea un no electrolito.
- El alcohol isopropílico es una molécula orgánica que contiene el grupo funcional alcohol. El enlace en el compuesto es todo covalente, por lo que cuando el alcohol isopropílico se disuelve, se separa en moléculas individuales pero no en iones. Por lo tanto, es un no electrolito
- El hidróxido de magnesio es un compuesto iónico, por lo que cuando se disuelve se disocia. Así, el hidróxido de magnesio es un electrolito.
Todas las siguientes sustancias se disuelven en cierta medida en agua. Clasificar cada uno como un electrolito o un no electrolito.
- acetona (CH 3 COCH 3)
- nitrato de hierro (III) [Fe (NO 3) 3]
- bromo elemental (Br 2)
- hidróxido de sodio (NaOH)
- Contestar
-
a. no electrolito
b. electrolito
c. no electrolitos
d. Electrolito
Electrolitos en Fluidos Corporales
Nuestros fluidos corporales son soluciones de electrolitos y muchas otras cosas. La combinación de sangre y sistema circulatorio es el río de la vida, porque coordina todas las funciones de la vida. Cuando el corazón deja de bombear en un ataque al corazón, la vida termina rápidamente. Reiniciar el corazón tan pronto como se pueda es crucial para mantener la vida.
Los electrolitos primarios requeridos en el fluido corporal son cationes (de calcio, potasio, sodio y magnesio) y aniones (de cloruro, carbonatos, aminoacetatos, fosfatos y yoduro). A estos se les llama nutricionalmente macrominerales.
El equilibrio electrolítico es crucial para muchas funciones corporales. Aquí hay algunos ejemplos extremos de lo que puede suceder con un desequilibrio de electrolitos: los niveles elevados de potasio pueden resultar en arritmias cardíacas; la disminución del potasio extracelular produce parálisis; el sodio extracelular excesivo causa retención de líquidos; y la disminución de calcio y magnesio en plasma puede producir músculo espasmos de las extremidades.
Cuando un paciente está deshidratado, se requiere una solución electrolítica cuidadosamente preparada (disponible comercialmente) para mantener la salud y el bienestar. En cuanto a la salud infantil, se administra electrolitos orales cuando un niño está deshidratado por diarrea. El uso de soluciones de mantenimiento de electrolitos orales, que se encarga de salvar millones de vidas en todo el mundo durante los últimos 25 años, es uno de los avances médicos más importantes en la protección de la salud de los niños en el siglo, explica Juilus G.K. Goepp, MD, subdirector de la Urgencias Pediátricas Departamento del Centro Infantil del Hospital Johns Hopkins. Si un padre proporciona una solución de mantenimiento electrolítico oral al comienzo de la enfermedad, se puede prevenir la deshidratación. La funcionalidad de las soluciones electrolíticas está relacionada con sus propiedades, y el interés en las soluciones electrolíticas va mucho más allá de la química.
Las bebidas deportivas están diseñadas para rehidratar el cuerpo después del agotamiento excesivo de líquidos. Los electrolitos en particular promueven la rehidratación normal para prevenir la fatiga durante el esfuerzo físico. ¿Son una buena opción para lograr la ingesta recomendada de líquidos? ¿Son potenciadores del rendimiento y la resistencia como afirman? ¿Quién debería beberlos?
Por lo general, ocho onzas de una bebida deportiva aportan entre cincuenta y ochenta calorías y de 14 a 17 gramos de carbohidratos, la mayoría en forma de azúcares simples. El sodio y el potasio son los electrolitos más comúnmente incluidos en las bebidas deportivas, siendo los niveles de estos en bebidas deportivas altamente variables. El Colegio Americano de Medicina Deportiva dice que una bebida deportiva debe contener 125 miligramos de sodio por cada 8 onzas ya que es útil para reponer parte del sodio perdido en el sudor y promueve la absorción de líquidos en el intestino delgado, mejorando la hidratación.
En el verano de 1965, el entrenador asistente de fútbol de la Universidad de Florida Gators solicitó a científicos afiliados a la universidad estudiar por qué el calor marchitante de Florida causó tantas enfermedades relacionadas con el calor en los futbolistas y brindar una solución para aumentar el rendimiento atlético y recuperación post-entrenamiento o juego. El descubrimiento fue que la inadecuada reposición de líquidos, carbohidratos y electrolitos fue la razón del “marchitamiento” de sus futbolistas. Con base en sus investigaciones, los científicos inventaron una bebida para los futbolistas que contenía agua, carbohidratos y electrolitos y la llamaron “Gatorade”. En la siguiente temporada futbolística los Gators fueron nueve y dos y ganaron el Orange Bowl. El éxito de los Gators lanzó la industria de las bebidas deportivas, que ahora es una industria multimillonaria que todavía está dominada por Gatorade.
de Florida causó tantas enfermedades relacionadas con el calor en los futbolistas y brindar una solución para aumentar el rendimiento atlético y recuperación post-entrenamiento o juego. El descubrimiento fue que la inadecuada reposición de líquidos, carbohidratos y electrolitos fue la razón del “marchitamiento” de sus futbolistas. Con base en sus investigaciones, los científicos inventaron una bebida para los futbolistas que contenía agua, carbohidratos y electrolitos y la llamaron “Gatorade”. En la siguiente temporada futbolística los Gators fueron nueve y dos y ganaron el Orange Bowl. El éxito de los Gators lanzó la industria de las bebidas deportivas, que ahora es una industria multimillonaria que todavía está dominada por Gatorade.
El futbolista de la Universidad de Florida Chip Hinton probó a Gatorade en 1965, en la foto junto al líder de su equipo de inventores, Robert Cade.
Ejercicio de revisión de conceptos
-
Explicar cómo el proceso de solvatación describe la disolución de un soluto en un disolvente.
Contestar
-
Cada partícula del soluto está rodeada por partículas del disolvente, transportando el soluto de su fase original.
Llave para llevar
- Cuando un soluto se disuelve, sus partículas individuales están rodeadas por moléculas de disolvente y se separan entre sí.
Ejercicios
-
Describir lo que sucede cuando un soluto iónico como Na 2 SO 4 se disuelve en un disolvente polar.
-
Describir lo que sucede cuando un soluto molecular como la sacarosa (C 12 H 22 O 11) se disuelve en un disolvente polar.
-
Clasificar cada sustancia como un electrolito o un no electrolito. Cada sustancia se disuelve en H 2 O hasta cierto punto.
- NH 4 NO 3
- CO 2
- NH 2 CONH 2
- HCl
-
Clasificar cada sustancia como un electrolito o un no electrolito. Cada sustancia se disuelve en H 2 O hasta cierto punto.
- CH 3 CH 2 CH 2 OH
- Ca (CH 3 CO 2) 2
- I 2
- KOH
-
¿Las soluciones de cada soluto conducirán la electricidad cuando se disuelvan?
- AgnO
- CHCl 3
- BacL
- Li 2 O
-
¿Las soluciones de cada soluto conducirán la electricidad cuando se disuelvan?
- CH 3 COCH 3
- N (CH 3) 3
- CH 3 CO 2 C 2 H 5
- FeCl 2
RESPUESTAS
-
Cada ion del soluto iónico está rodeado por partículas de disolvente, transportando el ion de su cristal asociado.
-
- electrolito
- no electrolítico
- no electrolítico
- electrolito
- no electrolítico
- electrolito
- no electrolítico
- electrolito
5.
- si
- no
- si
- si
6.

