9.9: Propiedades de las soluciones
- Page ID
- 73237
- Describir en qué se diferencian las propiedades de las soluciones de las de los solventes puros.
Es probable que las soluciones tengan propiedades similares a las de su componente principal, generalmente el solvente. Sin embargo, algunas propiedades de la solución difieren significativamente de las del disolvente. Aquí, nos enfocaremos en soluciones líquidas que tengan un soluto sólido, pero muchos de los efectos que discutiremos en esta sección son aplicables a todas las soluciones.
Propiedades coligativas
Los solutos afectan algunas propiedades de las soluciones que dependen únicamente de la concentración de las partículas disueltas. Estas propiedades se denominan propiedades coligativas. Cuatro propiedades colligativas importantes que examinaremos aquí son la depresión de la presión de vapor, la elevación del punto de ebullición, la depresión del punto de congelación y la presión osmótica.
Los compuestos moleculares se separan en moléculas individuales cuando se disuelven, así que por cada 1 mol de moléculas disueltas, obtenemos 1 mol de partículas. En contraste, los compuestos iónicos se separan en sus iones constituyentes cuando se disuelven, por lo que 1 mol de un compuesto iónico producirá más de 1 mol de partículas disueltas. Por ejemplo, cada mol de NaCl que se disuelve produce 1 mol de iones Na + y 1 mol de iones Cl −, para un total de 2 mol de partículas en solución. Así, el efecto sobre las propiedades de una solución al disolver NaCl puede ser dos veces más grande que el efecto de disolver la misma cantidad de moles de glucosa (C 6 H 12 O 6).
Depresión de Vapor
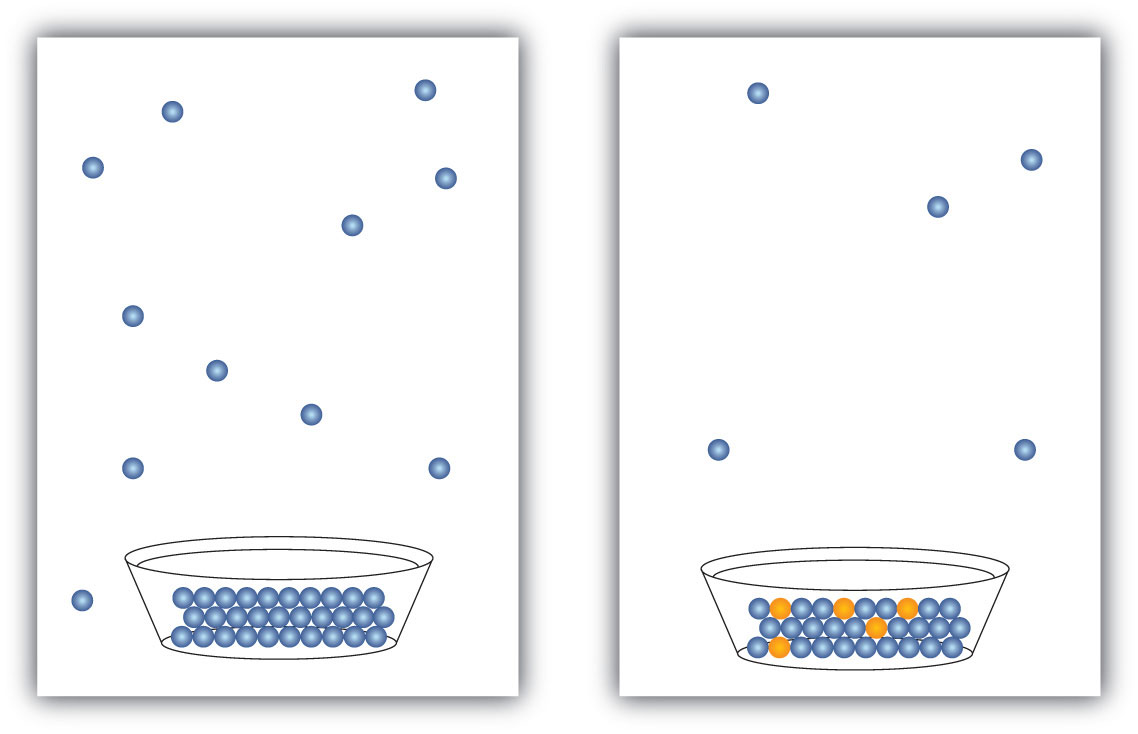
Todos los líquidos se evaporan. De hecho, dado el volumen suficiente, un líquido se convertirá completamente en vapor. Si no hay suficiente volumen, un líquido se evaporará solo hasta el punto en que la velocidad de evaporación sea igual a la velocidad de condensación de vapor de nuevo en un líquido. La presión del vapor en este punto se llama presión de vapor del líquido.
La presencia de un sólido disuelto disminuye la presión de vapor característica de un líquido para que se evapore más lentamente. (Las excepciones a esta afirmación son si el soluto en sí es un líquido o un gas, en cuyo caso el soluto también aportará algo al proceso de evaporación. No discutiremos este tipo de soluciones aquí.) Esta propiedad se denomina depresión de presión de vapor y se representa en la Figura\(\PageIndex{1}\).
Elevación del punto de ebullición
Una propiedad relacionada de las soluciones es que sus puntos de ebullición son más altos que el punto de ebullición del disolvente puro. Debido a que la presencia de partículas de soluto disminuye la presión de vapor del disolvente líquido, se necesita una temperatura más alta para alcanzar el punto de ebullición. Este fenómeno se llama elevación del punto de ebullición. Por cada mol de partículas disueltas en un litro de agua, el punto de ebullición del agua aumenta en aproximadamente 0.51°C La adición de un mol de sacarosa (compuesto molecular) en un litro de agua elevará el punto de ebullición de 100°C a 100.51°C pero la adición de un mol de NaCl en un litro de agua elevará el punto de ebullición en 2 x 0.51°C = 1.02°C. Además, la adición de un mol de\(\ce{CaCl2}\) en un litro de agua elevará el punto de ebullición en 3 x 0.51°C = 1.53°C.
Algunas personas argumentan que poner una pizca o dos de sal en el agua utilizada para cocinar espaguetis u otra pasta hace una solución que tiene un punto de ebullición más alto, por lo que la pasta se cocina más rápido. En la actualidad, la cantidad de soluto es tan pequeña que el punto de ebullición del agua prácticamente no cambia.
Depresión del punto de congelación
La presencia de partículas de soluto tiene el efecto contrario sobre el punto de congelación de una solución. Cuando una solución se congela, solo las partículas de disolvente se unen para formar una fase sólida, y la presencia de partículas de soluto interfiere con ese proceso. Por lo tanto, para que el solvente líquido se congele, se debe eliminar más energía de la solución, lo que baja la temperatura. Por lo tanto, las soluciones tienen puntos de congelación más bajos que los solventes puros. Este fenómeno se llama depresión del punto de congelación. Por cada mol de partículas en un litro de agua, el punto de congelación disminuye en aproximadamente 1.86°C.
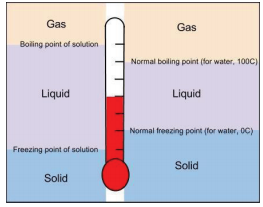
Tanto la elevación del punto de ebullición como la depresión del punto de congelación tienen usos prácticos. Por ejemplo, soluciones de agua y etilenglicol (C 2 H 6 O 2) se utilizan como refrigerantes en motores de automóviles debido a que el punto de ebullición de dicha solución es mayor a 100°C, el punto de ebullición normal del agua. En invierno, sales como NaCl y\(\ce{CaCl_2}\) se rocían en el suelo para derretir el hielo o evitar que se forme hielo en carreteras y aceras (Figura\(\PageIndex{3}\)). Esto se debe a que la solución hecha al disolver cloruro de sodio o cloruro de calcio en agua tiene un punto de congelación más bajo que el agua pura, por lo que se inhibe la formación de hielo.

¿Qué punto de congelación de la solución se desvía más del agua pura, una solución 1 M de NaCl o una solución 1 M de\(\ce{CaCl_2}\)?
Solución
Las propiedades coligativas dependen del número de partículas disueltas, por lo que la solución con el mayor número de partículas en solución mostrará la mayor desviación. Cuando el NaCl se disuelve, se separa en dos iones, Na + y Cl −. Pero cuando se\(\ce{CaCl2}\) disuelve, se separa en tres iones: un ion Ca 2 + y dos iones Cl −. Así, mol por mol,\(\ce{CaCl2}\) tendrá un 50% más de impacto en la depresión del punto de congelación que el NaCl.
¿Qué punto de ebullición de la solución se desvía más del agua pura, una solución 1 M\(\ce{CaCl2}\) o una solución 1 M de MgSO 4?
- Contestar
-
\(\ce{CaCl2}\)
Estimar el punto de ebullición de la\(\ce{CaCl2}\) solución 0.2 M.
Solución
El punto de ebullición aumenta 0.51°C por cada mol de soluto por litro de agua. Para esta estimación, supongamos que 1 litro de solución es aproximadamente el mismo volumen que 1 litro de agua. Una\(\ce{CaCl_2}\) solución 0.2 M contiene 0.2 moles de unidades de fórmula de\(\ce{CaCl_2}\) solución por litro de solución. Cada\(\ce{CaCl_2}\) unidad se separa en tres iones.
\[\mathrm{0.2\: mol\: CaCl_2\times\dfrac{3\: mol\: ions}{1\: mol\: CaCl_2}\times\dfrac{0.51° C}{1\: mol\: ion}=0.306° C} \nonumber \]
El punto de ebullición normal del agua es de 100°C, por lo que el punto de ebullición de la solución se eleva a 100.31°C.
Ejercicio\(\PageIndex{2}\)
Estimar el punto de congelación de la\(\ce{CaCl_2}\) solución 0.3 M.
- Contestar
-
—1.7°C

