9.10: Ósmosis y presión osmótica
- Page ID
- 73182
- Describir la ósmosis y cómo se relaciona con la presión osmótica.
Presión osmótica
La última propiedad coligativa de las soluciones que consideraremos es muy importante para los sistemas biológicos. Implica ósmosis, proceso por el cual las moléculas de disolvente pueden pasar a través de ciertas membranas pero las partículas de soluto no pueden. Cuando dos soluciones de diferente concentración están presentes a cada lado de estas membranas (llamadas membranas semipermeables), hay una tendencia a que las moléculas de disolvente pasen de la solución más diluida a la solución más concentrada hasta que las concentraciones de las dos soluciones sean iguales. Esta tendencia se llama presión osmótica. Se puede ejercer presión externa sobre una solución para contrarrestar el flujo de disolvente; la presión requerida para detener la ósmosis de un disolvente es igual a la presión osmótica de la solución.
La osmolaridad (osmol) es una forma de reportar el número total de partículas en una solución para determinar la presión osmótica. Se define como la molaridad de un soluto multiplicado por el número de partículas que hace una unidad de fórmula del soluto cuando se disuelve (representado por\(i\)):
\[osmol = M \times i\label{Eq1} \]
Si hay más de un soluto presente en una solución, las osmolaridades individuales son aditivas para obtener la osmolaridad total de la solución. Las soluciones que tienen la misma osmolaridad tienen la misma presión osmótica. Si están presentes soluciones de diferentes osmolaridades en lados opuestos de una membrana semipermeable, el disolvente se transferirá de la solución de osmolaridad inferior a la solución de osmolaridad superior. La contrapresión ejercida sobre la solución de alta osmolaridad reducirá o detendrá la transferencia de disolvente. Se puede ejercer una presión aún mayor para forzar el disolvente de la solución de alta osmolaridad a la solución de baja osmolaridad, un proceso llamado ósmosis inversa. La ósmosis inversa se utiliza para hacer agua potable a partir de agua salada donde las fuentes de agua dulce son escasas.
Una solución acuosa de NaCl 0.50 M y una solución acuosa 0.30 M Ca (NO 3) 2 se colocan en lados opuestos de una membrana semipermeable. Determinar la osmolaridad de cada solución y predecir la dirección del flujo de disolvente.
Solución
El disolvente fluirá hacia la solución de mayor osmolaridad. El soluto de NaCl se separa en dos iones —Na + y Cl − — cuando se disuelve, por lo que su osmolaridad es la siguiente:
osmol (NaCl) = 0.50 M × 2 = 1.0 osmol
El soluto Ca (NO 3) 2 se separa en tres iones —uno Ca 2 + y dos NO 3 − —cuando se disuelve, por lo que su osmolaridad es la siguiente:
osmol [Ca (NO 3) 2] = 0.30 M × 3 = 0.90 osmol
La osmolaridad de la solución de Ca (NO 3) 2 es menor que la de la solución de NaCl, por lo que el agua se transferirá a través de la membrana de la solución de Ca (NO 3) 2 a la solución de NaCl.
Una solución acuosa 1.5 M C 6 H 12 O 6 y una solución acuosa 0.40 M de Al (NO 3) 3 se colocan en lados opuestos de una membrana semipermeable. Determinar la osmolaridad de cada solución y predecir la dirección del flujo de disolvente.
- Responder
-
osmol C 6 H 12 O 6 = 1.5; osmol Al (NO 3) 3 = 1.6
El disolvente fluye de C 6 H 12 O 6 solución (menor osmolaridad) a\(\ce{Al(NO3)3}\) solución (mayor osmolaridad).
Las paredes celulares son membranas semipermeables, por lo que las presiones osmóticas de los fluidos corporales tienen importantes consecuencias biológicas. Si existen soluciones de diferente osmolaridad a ambos lados de las células, el disolvente (agua) puede pasar dentro o fuera de las células, a veces con resultados desastrosos. Considera lo que sucede si los glóbulos rojos se colocan en una solución hipotónica, es decir, una solución de menor osmolaridad que el líquido dentro de las células. Las células se hinchan a medida que el agua entra en ellas, interrumpiendo la actividad celular y eventualmente provocando que las células exploten. Este proceso se llama hemólisis. Si los glóbulos rojos se colocan en una solución hipertónica, es decir, uno que tiene una osmolaridad mayor que la que existe dentro de las células, el agua deja las células para diluir la solución externa, y los glóbulos rojos se marchitan y mueren. Este proceso se llama crenación. Solo si los glóbulos rojos se colocan en soluciones isotónicas que tienen la misma osmolaridad que existe dentro de las células, no se ven afectados por los efectos negativos de la presión osmótica. Las soluciones de glucosa de aproximadamente 0.31 M, o soluciones de cloruro de sodio de aproximadamente 0.16 M, son isotónicas con el plasma sanguíneo.
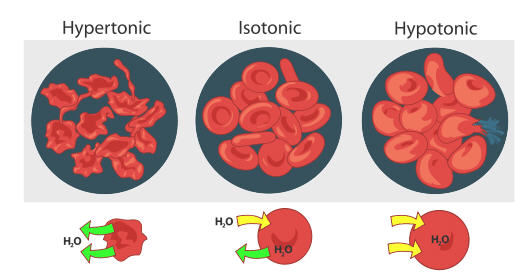
La concentración de una solución isotónica de cloruro de sodio (NaCl) es solo la mitad de la de una solución isotónica de glucosa (C 6 H 12 O 6) porque el NaCl produce dos iones cuando una unidad de fórmula se disuelve, mientras que C 6 H 12 O 6 molecular produce solo uno partícula cuando una unidad de fórmula se disuelve. Por lo tanto, las osmolaridades son las mismas aunque las concentraciones de las dos soluciones sean diferentes.
La presión osmótica explica por qué no debes beber agua de mar si estás abandonado en una balsa salvavidas en medio del océano. Su osmolaridad es aproximadamente tres veces mayor que la mayoría de los fluidos corporales. De hecho, te volverías más sediento a medida que el agua de tus celdas fuera sacada para diluir el agua salada del océano que ingiriste. Nuestros cuerpos hacen un mejor trabajo afrontando soluciones hipotónicas que con las hipertónicas. El exceso de agua es recolectada por nuestros riñones y excretada.
Los efectos de presión osmótica se utilizan en la industria alimentaria para hacer encurtidos a partir de pepinos y otras verduras y en salmuera para hacer carne en conserva. ¡También es un factor en el mecanismo de sacar agua desde las raíces hasta las copas de los árboles!

