11.4: Desintegración nuclear
- Page ID
- 73179
Objetivos de aprendizaje
- Escribir y equilibrar ecuaciones nucleares.
Los núcleos inestables emiten espontáneamente radiación en forma de partículas y energía. Esto generalmente cambia el número de protones y/o neutrones en el núcleo, resultando en un nucleido más estable. Un tipo de reacción nuclear es la desintegración radiactiva, una reacción en la que un núcleo se desintegra espontáneamente en un núcleo ligeramente más ligero, acompañado de la emisión de partículas, energía, o ambos. A continuación se muestra un ejemplo, en el que el núcleo de un átomo de polonio se desintegra radioactivamente en un núcleo de plomo.
\[\ce{^{235}_{92}U \rightarrow \, _2^4He + \, _{90}^{231}Th} \label{Eq2}\]
Obsérvese que en una ecuación nuclear equilibrada, la suma de los números atómicos (subíndices) y la suma de los números de masa (superíndices) deben ser iguales en ambos lados de la ecuación. ¿Cómo sabemos que es un producto de la reacción\(\ce{_{90}^{231}Th}\)? Utilizamos un tipo modificado de la ley de conservación de la materia, que dice que debemos tener el mismo número de protones y neutrones en ambos lados de la ecuación química. Si nuestro núcleo de uranio pierde 2 protones de la partícula alfa, entonces quedan 90 protones, identificando al elemento como torio. Además, si perdemos 4 partículas nucleares del 235 original, quedan 231. Así, utilizamos la resta para identificar el isótopo del átomo de torio, en este caso,\(\ce{^{231}_{90}Th}\).
Debido a que el número de protones cambia como consecuencia de esta reacción nuclear, la identidad del elemento cambia. La transmutación es un cambio en la identidad de un núcleo como consecuencia de un cambio en el número de protones. Existen varios tipos diferentes de desintegración radiactiva natural, y examinaremos cada uno por separado.
Emisión Alfa
Una partícula alfa\(\left( \alpha \right)\) es un núcleo de helio con dos protones y dos neutrones. Las partículas alfa se emiten durante algunos tipos de desintegración radiactiva. La carga neta de una partícula alfa es\(2+\), y su masa es aproximadamente\(4 \: \text{amu}\). El símbolo de una partícula alfa en una ecuación nuclear suele ser\(\ce{^4_2He}\), aunque a veces\(\alpha\) se usa. La emisión alfa suele ocurrir para núcleos muy pesados en los que los núcleos son inestables debido a la gran cantidad de nucleones. Para los núcleos que sufren desintegración alfa, su estabilidad se ve incrementada por la resta de dos protones y dos neutrones. Por ejemplo, el uranio-238 se desintegra en torio-234 por la emisión de una partícula alfa (ver Figura\(\PageIndex{1}\)).
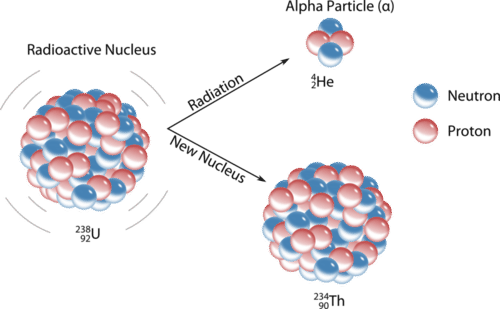
Ejemplo\(\PageIndex{1}\): Radón-222
Escriba la ecuación nuclear que representa la desintegración radiactiva del radón-222 por emisión de partículas alfa e identifique el isótopo hijo.
Solución
El radón tiene un número atómico de 86, por lo que el isótopo padre se representa como\(\ce{^{222}_{86}Rn}\). Representamos la partícula alfa como\(\ce{^{4}_{2}He}\) y usamos sustracción (222 − 4 = 218 y 86 − 2 = 84) para identificar el isótopo hijo como un isótopo de polonio,\(\mathrm{^{218}_{84}Po}\):
\[\ce{_{86}^{222}Rn\rightarrow \, _2^4He + \, _{84}^{218}Po} \nonumber\]
Ejercicio\(\PageIndex{1}\): Polonio-209
Escriba la ecuación nuclear que representa la desintegración radiactiva del polonio-209 por emisión de partículas alfa e identifique el isótopo hijo.
- Responder
-
\[\ce{_{84}^{209}Po\rightarrow \, _2^4He + \, _{82}^{205}Pb} \nonumber\]
Emisión Beta
Los núcleos por encima de la banda de estabilidad son inestables debido a que su relación de neutrones a protones es demasiado alta. Para disminuir esa relación, un neutrón en el núcleo es capaz de convertirse en un protón y un electrón. El electrón es inmediatamente expulsado a alta velocidad del núcleo. Una partícula beta\(\left( \beta \right)\) es un electrón de alta velocidad emitido desde el núcleo de un átomo durante algunos tipos de desintegración radiactiva (ver Figura\(\PageIndex{2}\)). El símbolo para una partícula beta en una ecuación es\(\beta\) o\(\ce{^0_{-1}e}\). El carbono-14 sufre desintegración beta, transmutando en un núcleo de nitrógeno-14.
\[\ce{^{14}_6C} \rightarrow \ce{^{14}_7N} + \ce{^0_{-1}e}\]
Tenga en cuenta que la desintegración beta aumenta el número atómico en uno, pero el número de masa sigue siendo el mismo.

Ejemplo\(\PageIndex{2}\): Boro-12
Escriba la ecuación nuclear que representa la desintegración radiactiva del boro-12 por emisión de partículas beta e identifique el isótopo hijo. Se emite un rayo gamma simultáneamente con la partícula beta.
Solución
El isótopo padre es\(\ce{^{12}_{5}B}\) mientras que uno de los productos es un electrón,\(\ce{^{0}_{-1}e}\). Para que la masa y los números atómicos tengan el mismo valor en ambos lados, el número de masa del isótopo hijo debe ser 12, y su número atómico debe ser 6. El elemento que tiene un número atómico de 6 es carbono. Así, la ecuación nuclear completa es la siguiente:
\[\ce{_5^{12}B\rightarrow \, _6^{12}C + \, _{-1}^0e + \gamma} \nonumber\]
El isótopo hijo es\(\ce{^{12}_6 C}\).
Ejercicio\(\PageIndex{2}\): yodo-131
Escribir la ecuación nuclear que representa la desintegración radiactiva del yodo-131 por emisión de partículas beta e identificar el isótopo hijo. Se emite un rayo gamma simultáneamente con la partícula beta.
- Responder
-
\[\ce{_53^{131}I\rightarrow \, _54^{131}Xe + \, _{-1}^0e + \gamma} \nonumber\]
Emisión Gamma
Los rayos gamma\(\left( \gamma \right)\) son ondas electromagnéticas de muy alta energía emitidas desde un núcleo. Los rayos gamma son emitidos por un núcleo cuando las partículas nucleares experimentan transiciones entre los niveles de energía nuclear. Esto es análogo a la radiación electromagnética emitida cuando los electrones excitados caen de niveles de energía más altos a menores; la única diferencia es que las transiciones nucleares liberan radiación mucho más energética. La emisión de rayos gamma suele acompañar la descomposición de un nucleido por otros medios.
\[\ce{^{230}_{90}Th} \rightarrow \ce{^{226}_{88}Ra} + \ce{^4_2He} + \gamma\]
La emisión de radiación gamma no tiene ningún efecto sobre el número atómico o número másico de los productos, pero reduce su energía.
Emisión de positrones
Los núcleos por debajo de la banda de estabilidad son inestables debido a que su relación de neutrones a protones es demasiado baja. Una forma de aumentar esa proporción es que un protón en el núcleo se convierta en un neutrón y otra partícula llamada positrón. Un positrón es una partícula con la misma masa que un electrón, pero con una carga positiva. Al igual que la partícula beta, un positrón es expulsado inmediatamente del núcleo tras su formación. El símbolo para un positrón en una ecuación es\(\ce{^0_{+1}e}\). Por ejemplo, el potasio-38 emite un positrón, convirtiéndose en argón-38.
\[\ce{^{38}_{19}K} \rightarrow \ce{^{38}_{18}Ar} + \ce{^0_1e}\]
La emisión de positrones disminuye el número atómico en uno, pero el número de masa sigue siendo el mismo.
Captura de electrones
Una forma alternativa para que un nucleido aumente su relación neutrón a protón es mediante un fenómeno llamado captura de electrones, E.C simpolizado En la captura de electrones, un electrón de un orbital interno es capturado por el núcleo del átomo y combinado con un protón para formar un neutrón. Por ejemplo, la plata-106 se somete a captura de electrones para convertirse en paladio-106.
\[\ce{^{106}_{47}Ag} + \ce{^0_{-1}e} \rightarrow \ce{^{106}_{46}Pd}\]
Tenga en cuenta que el resultado general de la captura de electrones es idéntico a la emisión de positrones. El número atómico disminuye en uno mientras que el número de masa sigue siendo el mismo.
Resumen de Nuclear Radiation
En la\(\PageIndex{1}\) tabla se enumeran las características de los diferentes tipos de desintegración radiactiva.
| Tipo | Símbolo | Cambio en el número atómico | Cambio en Número Masivo | Cambio en el número de neutrones |
|---|---|---|---|---|
| Emisión alfa | \(\ce{^4_2He}\)o\( \alpha \) | —2 | —4 | —2 |
| Emisión beta | \(\ce{^0_{-1}e}\)o\( \beta \) | +1 | 0 | —1 |
| Emisión gamma | \(\gamma\)o\(^0_0\gamma\) | 0 | 0 | 0 |
| Emisión de positrones | \(\ce{^0_1e}\)o\( \beta^+ \) | —1 | 0 | +1 |
| captura de electrones | E.C. | —1 | 0 | +1 |
Ejemplo\(\PageIndex{3}\)
Escribir una ecuación nuclear equilibrada para describir cada reacción.
- la desintegración beta de\(^{35}_{16}\textrm{S}\)
- la decadencia de\(^{201}_{80}\textrm{Hg}\) por captura de electrones
- la descomposición de\(^{30}_{15}\textrm{P}\) por emisión de positrones
Dado: nucleido radiactivo y modo de desintegración
Preguntado por: ecuación nuclear equilibrada
Estrategia:
A Identificar los reactivos y los productos a partir de la información proporcionada.
B Utilice los valores de A y Z para identificar los componentes faltantes necesarios para equilibrar la ecuación.
Solución
a.
A Conocemos las identidades del reactivo y uno de los productos (una partícula β). Por lo tanto, podemos comenzar escribiendo una ecuación que muestre el reactivo y uno de los productos e indique el producto desconocido como\(^{A}_{Z}\textrm{X}\):\[^{35}_{16}\textrm{S}\rightarrow\,^{A}_{Z}\textrm{X}+\,^{0}_{-1}\beta \nonumber\]
B Debido a que tanto los protones como los neutrones deben conservarse en una reacción nuclear, el producto desconocido debe tener un número de masa de A = 35 − 0 = 35 y un número atómico de Z = 16 − (−1) = 17. El elemento con Z = 17 es cloro, por lo que la ecuación nuclear balanceada es la siguiente:\[^{35}_{16}\textrm{S}\rightarrow\,^{35}_{17}\textrm{Cl}+\,^{0}_{-1}\beta \nonumber\]
b.A Conocemos las identidades de ambos reactivos:\(^{201}_{80}\textrm{Hg}\) y un electrón interno,\(^{0}_{-1}\textrm{e}\). La reacción es la siguiente:\[^{201}_{80}\textrm{Hg}+\,^{0}_{-1}\textrm e\rightarrow\,^{A}_{Z}\textrm{X} \nonumber\]
B Se conservan tanto protones como neutrones, por lo que el número de masa del producto debe ser A = 201 + 0 = 201, y el número atómico del producto debe ser Z = 80 + (−1) = 79, que corresponde al elemento oro. La ecuación nuclear equilibrada es así\[^{201}_{80}\textrm{Hg}+\,^{0}_{-1}\textrm e\rightarrow\,^{201}_{79}\textrm{Au} \nonumber\]
c.A Como en la parte (a), se nos dan las identidades del reactivo y uno de los productos, en este caso, un positrón. Por lo tanto, la ecuación nuclear desequilibrada es\[^{30}_{15}\textrm{P}\rightarrow\,^{A}_{Z}\textrm{X}+\,^{0}_{+1}\beta \nonumber\]
B El número de masa del segundo producto es A = 30 − 0 = 30, y su número atómico es Z = 15 − 1 = 14, que corresponde al silicio. La ecuación nuclear equilibrada para la reacción es la siguiente:\[^{30}_{15}\textrm{P}\rightarrow\,^{30}_{14}\textrm{Si}+\,^{0}_{+1}\beta \nonumber\]
Ejercicio\(\PageIndex{3}\)
Escribir una ecuación nuclear equilibrada para describir cada reacción.
- \(^{11}_{6}\textrm{C}\)por emisión de positrones
- la desintegración beta del molibdeno-99
- la emisión de una partícula α seguida de la emisión gamma de\(^{185}_{74}\textrm{W}\)
- Responder a
-
\(^{11}_{6}\textrm{C}\rightarrow\,^{11}_{5}\textrm{B}+\,^{0}_{+1}\beta\)
- Respuesta d
-
\(^{99}_{42}\textrm{Mo}\rightarrow\,^{99m}_{43}\textrm{Tc}+\,^{0}_{-1}\beta\)
- Respuesta c
-
\(^{185}_{74}\textrm{W}\rightarrow\,^{181}_{72}\textrm{Hf}+\,^{4}_{2}\alpha +\,^{0}_{0}\gamma\)
Ejemplo\(\PageIndex{4}\)
Predecir el tipo de cambio nuclear que experimenta cada nucleido inestable cuando decae.
- \(^{45}_{22}\textrm{Ti}\)
- \(^{242}_{94}\textrm{Pu}\)
- \(^{12}_{5}\textrm{B}\)
- \(^{256}_{100}\textrm{Fm}\)
Dado: nucleido
Preguntado por: tipo de desintegración nuclear
Estrategia:
Con base en la relación neutrón-protón y el valor de Z, predecir el tipo de reacción de desintegración nuclear que producirá un nucleido más estable.
Solución
- Este nucleido tiene una relación neutrón-protón de sólo 1.05, que es mucho menor que el requisito de estabilidad para un elemento con un número atómico en este rango. Los núcleos que tienen bajas relaciones neutrón-protón se descomponen al convertir un protón en un neutrón. Las dos posibilidades son la emisión de positrones, que convierte un protón en un neutrón y un positrón, y la captura de electrones, que convierte un protón y un electrón central en un neutrón. En este caso, se observan ambos, con emisión de positrones ocurriendo alrededor del 86% del tiempo y captura de electrones alrededor del 14% del tiempo.
- Los núcleos con Z > 83 son demasiado pesados para ser estables y suelen sufrir desintegración alfa, lo que disminuye tanto el número másico como el número atómico. Por lo tanto,\(^{242}_{94}\textrm{Pu}\) se espera que desaparezca por emisión alfa.
- Este nucleido tiene una relación neutrón-protón de 1.4, que es muy alta para un elemento ligero. Los núcleos con altas relaciones neutrón-protón se descomponen al convertir un neutrón en un protón y un electrón. El electrón se emite como una partícula β, y el protón permanece en el núcleo, provocando un aumento en el número atómico sin cambio en el número de masa. Por lo tanto, predecimos que\(^{12}_{5}\textrm{B}\) sufrirá desintegración beta.
- Se trata de un nucleido masivo, con un número atómico de 100 y un número de masa mucho mayor que 200. Los nucleidos con A ≥ 200 tienden a descomponerse por emisión alfa, e incluso los núcleos más pesados tienden a sufrir fisión espontánea. Por lo tanto, predecimos que\(^{256}_{100}\textrm{Fm}\) se desintegrará por uno o ambos de estos dos procesos. De hecho, decae tanto por fisión espontánea como por emisión alfa, en una proporción 97:3.
Ejercicio\(\PageIndex{4}\)
Predecir el tipo de cambio nuclear que experimenta cada nucleido inestable cuando decae.
- \(^{32}_{14}\textrm{Si}\)
- \(^{43}_{21}\textrm{Sc}\)
- \(^{231}_{91}\textrm{Pa}\)
- Responder a
-
decaimiento beta
- Respuesta d
-
emisión de positrones o captura de electrones
- Respuesta c
-
desintegración alfa
Colaboradores y Atribuciones
CK-12 Foundation by Sharon Bewick, Richard Parsons, Therese Forsythe, Shonna Robinson, and Jean Dupon.
Allison Soult, Ph.D. (Department of Chemistry, University of Kentucky)

