11.5: Semivida radiactiva
- Page ID
- 73196
Objetivos de aprendizaje
- Definir la vida media.
- Determinar la cantidad de sustancia radiactiva que queda después de un número dado de semividas.
- Describir la técnica común de datación radiométrica por carbono-14.
Si un isótopo dado es radiactivo o no es una característica de ese isótopo en particular. Algunos isótopos son estables indefinidamente, mientras que otros son radiactivos y se descomponen a través de una forma característica de emisión. A medida que pasa el tiempo, cada vez menos isótopo radiactivo estará presente, y el nivel de radiactividad disminuye. Un aspecto interesante y útil de la desintegración radiactiva es la semivida (t 1/2), que es la cantidad de tiempo que tarda la mitad de un isótopo radiactivo en descomponerse. La vida media de un isótopo radiactivo específico es constante; no se ve afectada por las condiciones y es independiente de la cantidad inicial de ese isótopo.
Cada nucleido radiactivo tiene una vida media característica constante (t 1/2), el tiempo requerido para que la mitad de los átomos en una muestra se descomponga. La vida media de un isótopo nos permite determinar cuánto tiempo estará disponible una muestra de un isótopo útil y cuánto tiempo debe almacenarse una muestra de un isótopo indeseable o peligroso antes de que descomponga a un nivel de radiación lo suficientemente bajo que ya no es un problema.
Por ejemplo, la fuente de cobalto-60, ya que la mitad de los\(\ce{^{60}_{27}Co}\) núcleos se descomponen cada 5.27 años, tanto la cantidad de material como la intensidad de la radiación emitida se reduce a la mitad cada 5.27 años. (Obsérvese que para una sustancia dada, la intensidad de radiación que produce es directamente proporcional a la tasa de descomposición de la sustancia y la cantidad de la sustancia.) Por lo tanto, una fuente de cobalto-60 que se utiliza para el tratamiento del cáncer debe ser reemplazada regularmente para seguir siendo efectiva.

Podemos determinar la cantidad de un isótopo radiactivo que queda después de un número dado de semividas usando la siguiente expresión:
\[\text{amount remaining} = \text{initial amount} \times \left ( \frac{1}{2} \right )^{n}\]
donde\(n\) está el número de vidas medias. Esta expresión funciona aunque el número de vidas medias no sea un número entero.
Ejemplo\(\PageIndex{1}\): Fluorine-20
La vida media del fluor-20 es de 11.0 s. Si una muestra contiene inicialmente 5.00 g de fluor-20, ¿cuánto queda después de 44.0 s?
Solución
Si comparamos el tiempo que ha pasado a la vida media del isótopo, observamos que 44.0 s es exactamente 4 semividas, por lo que usando la expresión anterior, n = 4. Sustituir y resolver resultados en lo siguiente:
\[\begin{align*} \text{amount remaining} &= 5.00\,g \times \left ( \frac{1}{2} \right )^{4} \\[4pt] & =\: 5.00\,g\times \left ( \frac{1}{16} \right ) \\[4pt] &= 0.313\,g \end{align*}\]
Queda menos de un tercio de gramo de fluor-20.
Ejercicio\(\PageIndex{1}\): Titanio-44
La vida media del titanio-44 es de 60.0 y. Una muestra de titanio contiene 0.600 g de titanio-44. ¿Cuánto queda después de 240.0 y?
- Responder
-
0.0375 g
Las vidas medias de los isótopos van desde fracciones de microsegundo hasta miles de millones de años. Cuadro\(\PageIndex{1}\) - Semividas de Varios Isótopos, enumera las semividas de algunos isótopos.
| Isótopo | Half-Life |
|---|---|
| 3 H | 12.3 y |
| 14 C | 5730 y |
| 40 K | 1.26 × 10 9 y |
| 51 Cr | 27.70 d |
| 90 Sr | 29.1 y |
| 131 I | 8.04 d |
| 222 Rn | 3.823 d |
| 235 U | 7.04 × 10 8 y |
| 238 U | 4.47 × 10 9 y |
| 241 Am | 432.7 y |
| 248 Bk | 23.7 h |
| 260 Sg | 4 ms |
La química está en todas partes: elementos radiactivos en el cuerpo
Puede que no te consideres radiactivo, pero lo eres. Una pequeña porción de ciertos elementos en el cuerpo humano son radiactivos y sufren constantemente descomposición. La mayor parte de la radiactividad en el cuerpo humano proviene del potasio-40 y del carbono-14. El potasio y el carbono son dos elementos sin los que absolutamente no podemos vivir, así que a menos que podamos eliminar todos los isótopos radiactivos de estos elementos, no hay forma de escapar al menos alguna radiactividad. Existe debate sobre qué elemento radiactivo es más problemático. Hay más potasio-40 en el cuerpo que el carbono-14, y tiene una vida media mucho más larga. El potasio-40 también se descompone con aproximadamente 10 veces más energía que el carbono-14, lo que hace que cada decaimiento sea potencialmente más problemático. Sin embargo, el carbono es el elemento que forma la cadena principal de la mayoría de las moléculas vivas, haciendo que el carbono-14 sea más probable que esté presente alrededor de moléculas importantes, como las proteínas y las moléculas de ADN. La mayoría de los expertos coinciden en que si bien es temerario esperar absolutamente ninguna exposición a la radiactividad, podemos y debemos minimizar la exposición al exceso de radiactividad.
Datación radiométrica
Varios radioisótopos tienen semividas y otras propiedades que los hacen útiles con fines de “fechar” el origen de objetos como artefactos arqueológicos, anteriormente organismos vivos o formaciones geológicas. La radiactividad del carbono-14 proporciona un método para fechar objetos que formaban parte de un organismo vivo. Este método de datación radiométrica, que también se llama datación por radiocarbono o datación por carbono-14, es preciso para fechar sustancias que contienen carbono que tienen hasta aproximadamente 30,000 años de antigüedad, y puede proporcionar fechas razonablemente precisas hasta un máximo de aproximadamente 50,000 años de antigüedad.
El carbono natural consta de tres isótopos:\(\ce{^{12}_6C}\), que constituye aproximadamente 99% del carbono en la tierra;\(\ce{^{13}_6C}\), aproximadamente 1% del total; y trazas de\(\ce{^{14}_6C}\). El carbono-14 se forma en la atmósfera superior por la reacción de los átomos de nitrógeno con los neutrones de los rayos cósmicos en el espacio:
\[\ce{^{14}_7N + ^1_0n⟶ ^{14}_6C + ^1_1H}\nonumber \]
Todos los isótopos de carbono reaccionan con el oxígeno para producir moléculas de CO 2. La relación de\(\ce{^{14}_6CO2}\) a\(\ce{^{12}_6CO2}\) depende de la relación de\(\ce{^{14}_6CO}\) a\(\ce{^{12}_6CO}\) en la atmósfera. La abundancia natural\(\ce{^{14}_6CO}\) en la atmósfera es de aproximadamente 1 parte por billón; hasta hace poco, esto ha sido generalmente constante a lo largo del tiempo, ya que se ven muestras de gas que se encuentran atrapadas en el hielo. La incorporación de\(\ce{^{14}_6C ^{14}_6CO2}\) y\(\ce{^{12}_6CO2}\) dentro de las plantas es una parte regular del proceso de fotosíntesis, lo que significa que la\(\ce{^{14}_6C: ^{12}_6C}\) proporción que se encuentra en una planta viva es la misma que la\(\ce{^{14}_6C: ^{12}_6C}\) proporción en la atmósfera. Pero cuando la planta muere, ya no atrapa carbono a través de la fotosíntesis. Debido a que\(\ce{^{12}_6C}\) es un isótopo estable y no sufre desintegración radiactiva, su concentración en la planta no cambia. Sin embargo, el carbono-14 decae por emisión β con una vida media de 5730 años:
\[\ce{^{14}_6C⟶ ^{14}_7N + ^0_{-1}e}\nonumber \]
Así, la\(\ce{^{14}_6C: ^{12}_6C}\) proporción disminuye gradualmente después de la muerte de la planta. La disminución en la relación con el tiempo proporciona una medida del tiempo que ha transcurrido desde la muerte de la planta (u otro organismo que se comió la planta). La figura representa\(\PageIndex{2}\) visualmente este proceso.
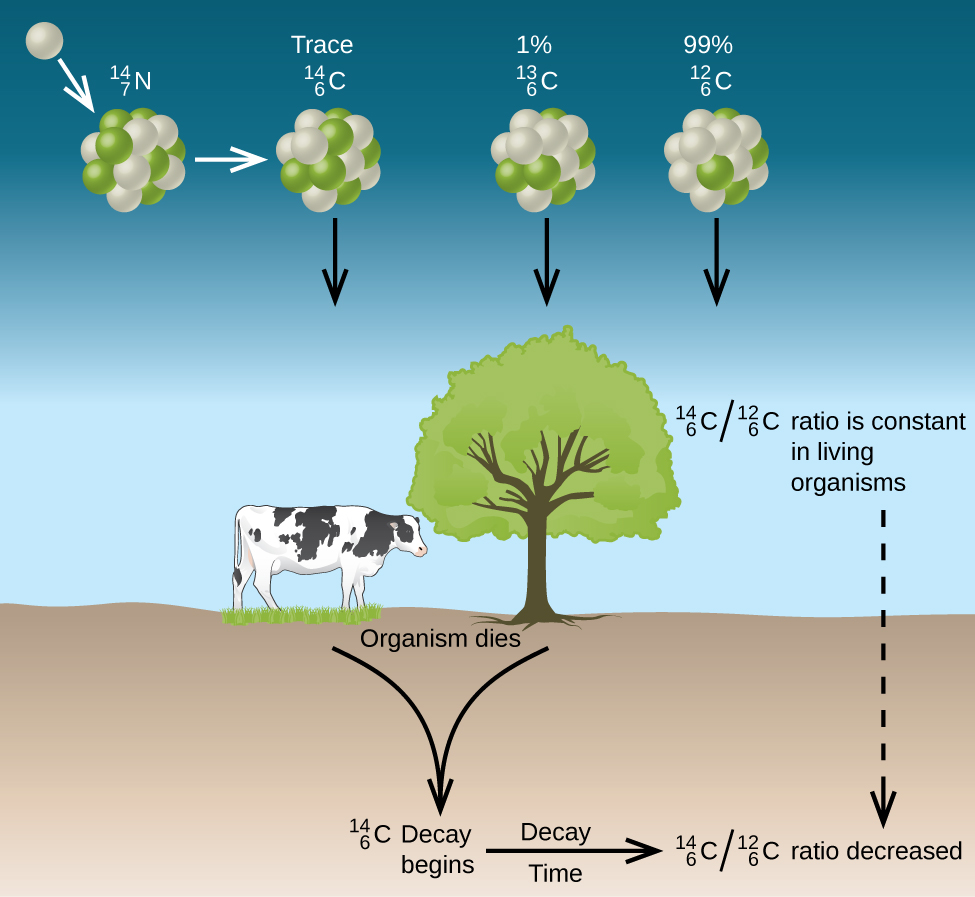
Por ejemplo, con la vida media de\(\ce{^{14}_6C}\) ser de 5730 años, si la\(\ce{^{14}_6C : ^{12}_6C}\) proporción en un objeto de madera que se encuentra en una excavación arqueológica es la mitad de lo que es en un árbol vivo, esto indica que el objeto de madera tiene 5730 años de antigüedad. Se pueden obtener determinaciones de\(\ce{^{14}_6C : ^{12}_6C}\) proporciones de alta precisión a partir de muestras muy pequeñas (tan solo un miligramo) mediante el uso de un espectrómetro de masas.
Principales conclusiones
- Los procesos radiactivos naturales se caracterizan por una vida media, el tiempo que tarda la mitad del material en descomponerse radiactivamente.
- La cantidad de material sobrante después de un cierto número de vidas medias se puede calcular fácilmente.

