12.1: La naturaleza de las moléculas orgánicas
- Page ID
- 73419
- Describir las propiedades estructurales básicas de las moléculas orgánicas simples.
La química orgánica es el estudio de la química de los compuestos que contienen carbono. El carbono se destaca porque tiene una diversidad química inigualable por ningún otro elemento químico. Su diversidad se basa en lo siguiente:
- Los átomos de carbono se unen razonablemente fuertemente con otros átomos de carbono.
- Los átomos de carbono se unen razonablemente fuertemente con átomos de otros elementos.
- Los átomos de carbono forman una gran cantidad de enlaces covalentes (cuatro).
Curiosamente, el carbono elemental no es particularmente abundante. Ni siquiera aparece en la lista de los elementos más comunes en la corteza terrestre. Sin embargo, todos los seres vivos consisten en compuestos orgánicos. La mayoría de los químicos orgánicos son compuestos covalentes, razón por la cual introducimos aquí la química orgánica. Por convención, los compuestos que contienen iones carbonato e iones bicarbonato, así como dióxido de carbono y monóxido de carbono, no se consideran parte de la química orgánica, a pesar de que contienen carbono.
Propiedades estructurales de los compuestos de carbono
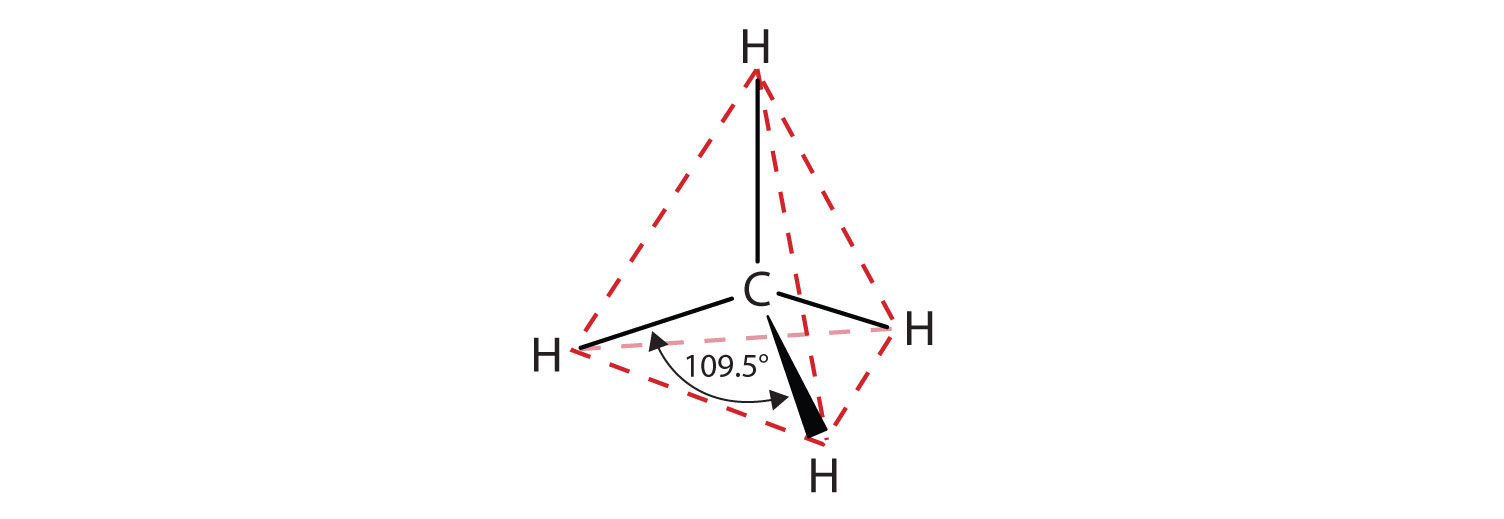
Un átomo de carbono tiene cuatro electrones de valencia, es tetravalente. El carbono puede formar cuatro enlaces covalentes, o compartir electrones con hasta cuatro átomos para obtener un octeto completo. Los compuestos de carbono más simples contienen solo carbono e hidrógeno y se llaman hidrocarburos. El metano, el hidrocarburo más simple, contiene un solo carbono con cuatro átomos de hidrógeno unidos covalentemente. Recordando lo que has aprendido sobre las estructuras moleculares y VSEPR, sabemos que el metano es tetraédrico (cuatro grupos de electrones y no hay pares solitarios).
El carbono también puede formar dobles enlaces al compartir cuatro electrones con un átomo de carbono vecino o enlaces triples al compartir seis electrones con un átomo de carbono vecino. Como se muestra en la Figura\(\PageIndex{2}\) siguiente, el carbono con tres grupos de electrones unidos será plano trigonal, y el carbono con dos grupos de electrones unidos será lineal.
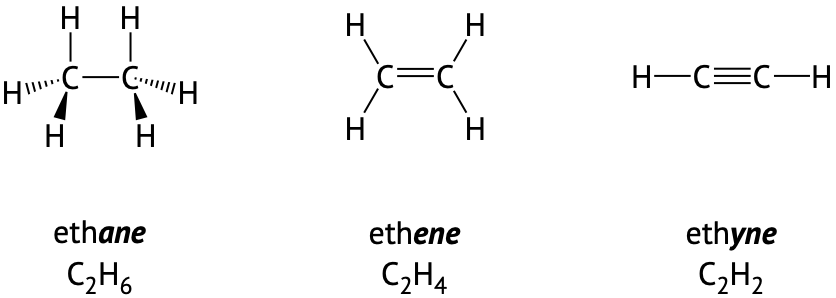
Figura\(\PageIndex{2}\): Dos carbonos pueden unirse juntos en un enlace sencillo, un doble enlace o un triple enlace. Observe, en cada ejemplo el carbono hace cuatro enlaces totales. El número de átomos de hidrógeno en cada molécula disminuye a medida que aumenta el número de enlaces carbono-carbono.
Los compuestos de hidrocarburos simples son no polares debido a la forma y la pequeña diferencia de electronegatividad entre los átomos de carbono e hidrógeno. Cuando el carbono está unido a un átomo de halógeno u oxígeno, el enlace resultante es polar. Puede ser útil revisar la sección sobre electronegatividad y polaridad de enlaces y moléculas para poder describir las propiedades de diferentes compuestos orgánicos, específicamente cómo reaccionan e interactúan con otras moléculas.
Comparación de compuestos orgánicos e inorgánicos
Los compuestos orgánicos, al igual que los compuestos inorgánicos, obedecen a todas las leyes naturales. A menudo no hay una distinción clara en las propiedades químicas o físicas entre las moléculas orgánicas e inorgánicas. Sin embargo, es útil comparar miembros típicos de cada clase, como en Tabla\(\PageIndex{1}\). Tenga en cuenta, sin embargo, que hay excepciones a cada categoría en esta tabla.
| Propiedades Orgánicas | Ejemplo: Hexano | Propiedades inorgánicas | Ejemplo: NaCl |
|---|---|---|---|
| puntos de fusión bajos | −95°C | altos puntos de fusión | 801°C |
| puntos de ebullición bajos | 69°C | puntos de ebullición altos | 1,413°C |
| baja solubilidad en agua; alta solubilidad en disolventes no polares | insoluble en agua; soluble en gasolina | mayor solubilidad en agua; baja solubilidad en disolventes no polares | soluble en agua; insoluble en gasolina |
| inflamable | altamente inflamable | no inflamables | no inflamables |
| las soluciones acuosas no conducen la electricidad | no conductivo | las soluciones acuosas conducen la electricidad | conductor en solución acuosa |
| exhibir enlace covalente | enlaces covalentes | exhibir unión iónica | enlaces iónicos |


