13.8: Compuestos aromáticos y la estructura del benceno
- Page ID
- 72703
- Describir la unión en benceno y la forma en que las reacciones típicas del benceno difieren de las de los alquenos.
A continuación consideramos una clase de hidrocarburos con fórmulas moleculares como las de los hidrocarburos insaturados, pero que, a diferencia de los alquenos, no experimentan fácilmente reacciones de adición. Estos compuestos comprenden una clase distinta, llamados hidrocarburos aromáticos, con estructuras y propiedades únicas. Comenzamos con el más simple de estos compuestos. El benceno (C 6 H 6) es de gran importancia comercial, pero también tiene efectos notables en la salud.
La fórmula C 6 H 6 parece indicar que el benceno tiene un alto grado de insaturación. (Hexano, el hidrocarburo saturado con seis átomos de carbono tiene la fórmula C 6 H 14 —ocho más átomos de hidrógeno que el benceno). Sin embargo, a pesar del aparentemente bajo nivel de saturación, el benceno es bastante poco reactivo. No reacciona, por ejemplo, fácilmente con el bromo, que, es una prueba para la insaturación.
Nota
El benceno es un líquido que huele a gasolina, hierve a 80°C y se congela a 5.5°C, es el hidrocarburo aromático producido en el mayor volumen. Anteriormente se usaba para descafeinar café y era un componente importante de muchos productos de consumo, como decapantes de pintura, cementos de caucho y removedores de manchas para limpieza en seco para el hogar. Se eliminó de muchas formulaciones de productos en la década de 1950, pero otras continuaron usando benceno en los productos hasta la década de 1970 cuando se asoció con muertes por leucemia. El benceno sigue siendo importante en la industria como precursor en la producción de plásticos (como espuma de poliestireno y nylon), drogas, detergentes, caucho sintético, pesticidas y tintes. Se utiliza como solvente para cosas tales como limpiar y mantener equipos de impresión y para adhesivos como los que se utilizan para fijar suelas a zapatos. El benceno es un constituyente natural de los productos derivados del petróleo, pero debido a que es un conocido carcinógeno, su uso como aditivo en la gasolina es ahora limitado.
Para explicar las sorprendentes propiedades del benceno, los químicos suponen que la molécula tiene una estructura cíclica, hexagonal y plana de seis átomos de carbono con un átomo de hidrógeno unido a cada uno. Podemos escribir una estructura con enlaces simples y dobles alternos, ya sea como una fórmula estructural completa o como una fórmula de ángulo de línea:
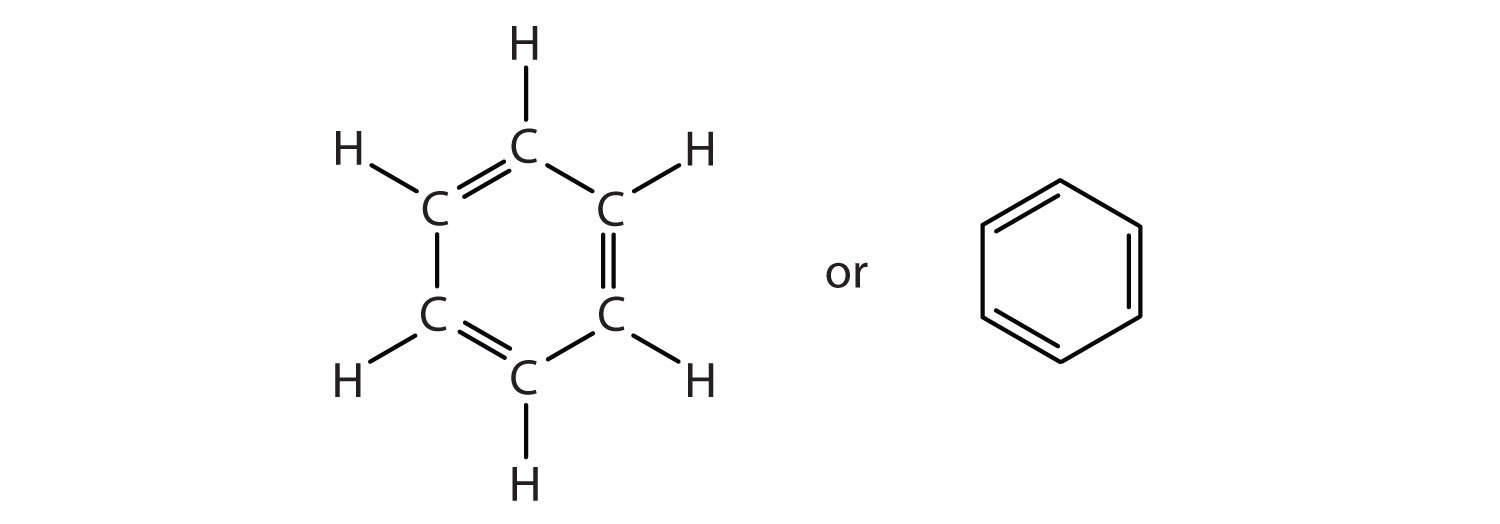
Sin embargo, estas estructuras no explican las propiedades únicas del benceno. Además, la evidencia experimental indica que todos los enlaces carbono-carbono en el benceno son equivalentes, y la molécula es inusualmente estable. Los químicos a menudo representan el benceno como un hexágono con un círculo inscrito:
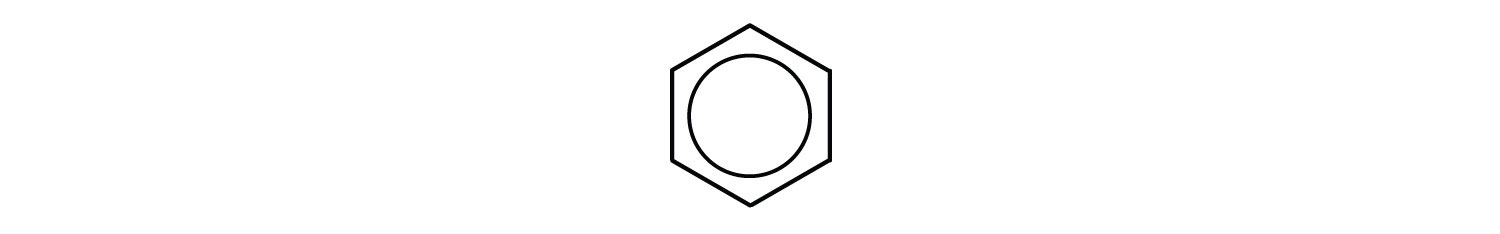
El círculo interno indica que los electrones de valencia son compartidos por igual por los seis átomos de carbono (es decir, los electrones están deslocalizados, o dispersos, sobre todos los átomos de carbono). Se entiende que cada esquina del hexágono está ocupada por un átomo de carbono, y cada átomo de carbono tiene un átomo de hidrógeno unido a él. Cualquier otro átomo o grupos de átomos sustituidos por un átomo de hidrógeno deben mostrarse unidos a una esquina particular del hexágono. Usamos este simbolismo moderno, pero muchos científicos todavía usan la estructura anterior con enlaces dobles y simples alternos.
La mayor parte del benceno utilizado comercialmente proviene del petróleo. Se emplea como material de partida para la producción de detergentes, drogas, tintes, insecticidas y plásticos. Una vez ampliamente utilizado como disolvente orgánico, ahora se sabe que el benceno tiene efectos tóxicos tanto a corto como a largo plazo. La inhalación de grandes concentraciones puede provocar náuseas e incluso la muerte por insuficiencia respiratoria o cardíaca, mientras que la exposición repetida conduce a una enfermedad progresiva en la que la capacidad de la médula ósea para producir nuevas células sanguíneas finalmente se destruye. Esto da como resultado una condición llamada anemia aplásica, en la que se produce una disminución en el número tanto de los glóbulos rojos como de los blancos.

