14.4: Reacciones de Alcoholes
- Page ID
- 73404
- Dar dos tipos principales de reacciones de alcoholes.
- Describir el resultado de la oxidación de un alcohol primario.
- Describir el resultado de la oxidación de un alcohol secundario.
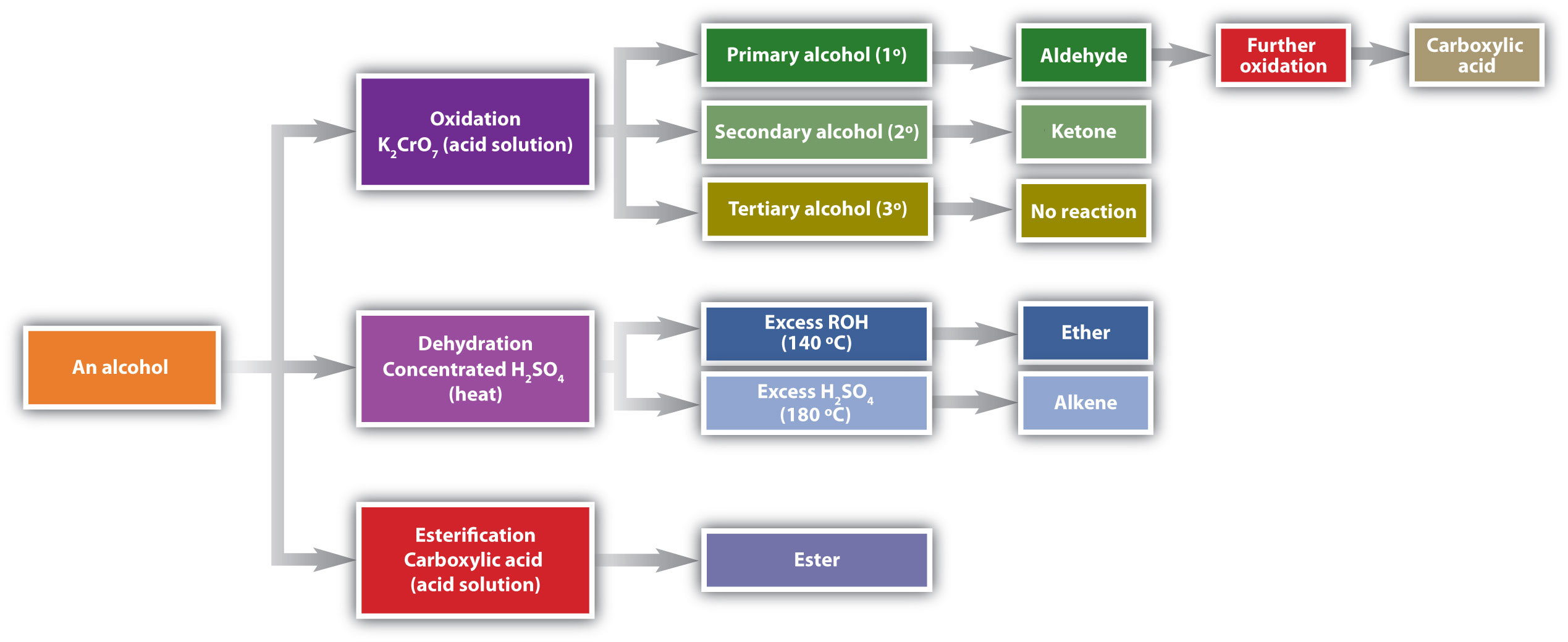
Las reacciones químicas en los alcoholes ocurren principalmente en el grupo funcional, pero algunas involucran átomos de hidrógeno unidos al átomo de carbono portador de OH o a un átomo de carbono adyacente. De los tres tipos principales de reacciones de alcohol, que se resumen en la Figura\(\PageIndex{1}\), se consideran dos —deshidratación y oxidación—. El tercer tipo de reacción, la esterificación, está cubierto en otra parte.
-
Deshidratación
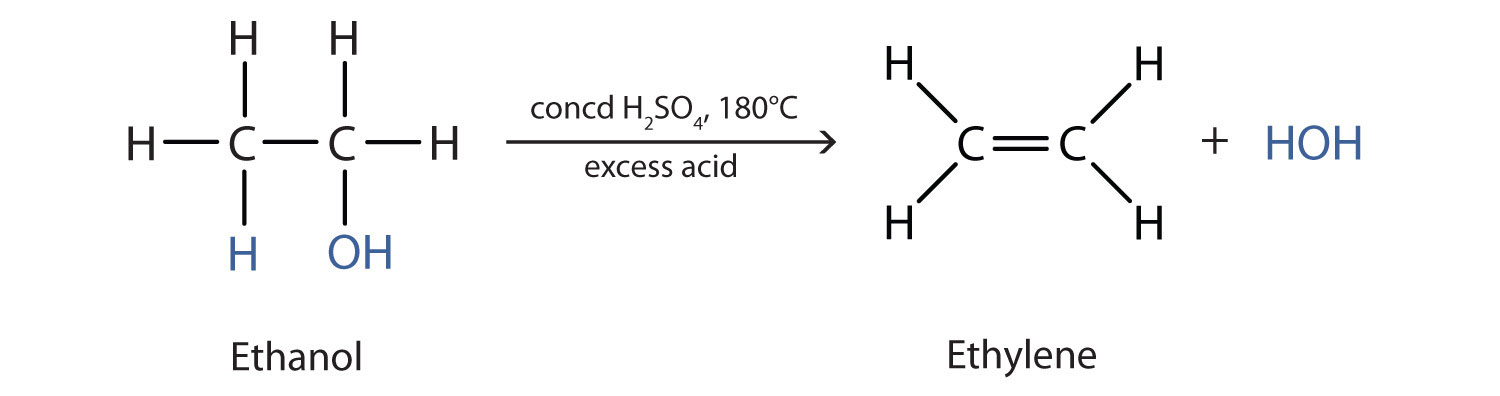
Como se observa en la Figura\(\PageIndex{1}\), un alcohol sufre deshidratación en presencia de un catalizador para formar un alqueno y agua. La reacción elimina el grupo OH del átomo de carbono del alcohol y un átomo de hidrógeno de un átomo de carbono adyacente en la misma molécula:
En las condiciones adecuadas, es posible que la deshidratación ocurra entre dos moléculas de alcohol. Se eliminan todo el grupo OH de una molécula y solo el átomo de hidrógeno del grupo OH de la segunda molécula. Los dos grupos etilo unidos a un átomo de oxígeno forman una molécula de éter.
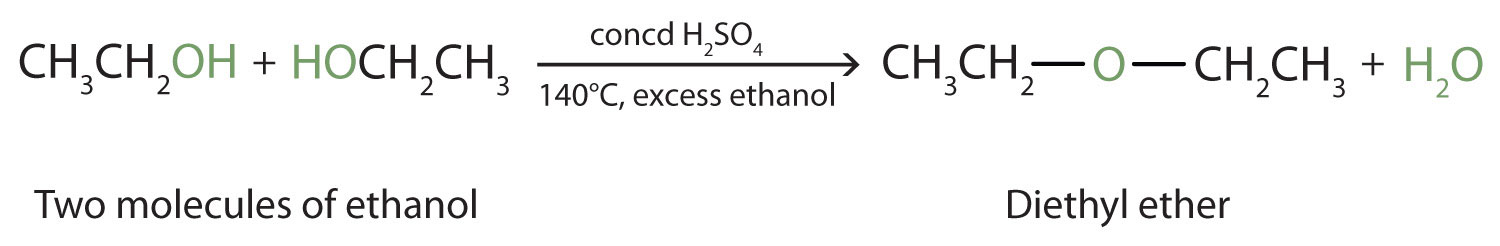
(Los éteres se discuten en otra parte) Así, dependiendo de las condiciones, se pueden preparar alquenos o éteres por la deshidratación de alcoholes.
Tanto las reacciones de deshidratación como de hidratación ocurren continuamente en el metabolismo celular, con enzimas que sirven como catalizadores y a una temperatura de aproximadamente 37°C, la siguiente reacción ocurre en la vía “Embden—Meyerhof”
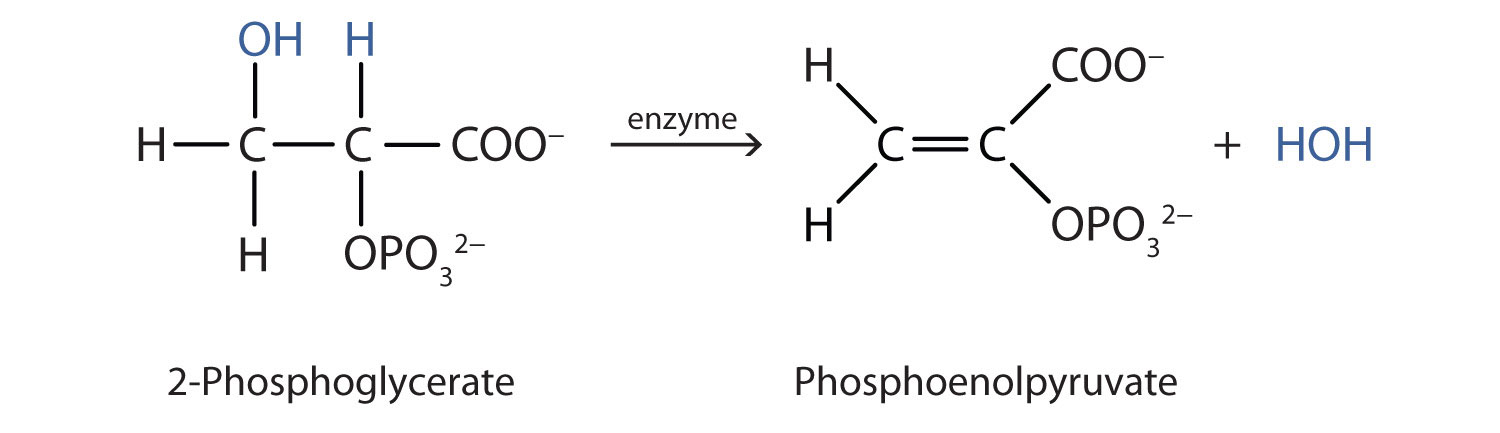
Aunque los compuestos participantes son complejos, la reacción es la misma: eliminación del agua del material de partida. La idea es que si conoces la química de un grupo funcional en particular, conozcas la química de cientos de compuestos diferentes.
Oxidación
Los alcoholes primarios y secundarios se oxidan fácilmente. Anteriormente vimos cómo el metanol y el etanol son oxidados por las enzimas hepáticas para formar aldehídos. Debido a que una variedad de agentes oxidantes pueden provocar oxidación, podemos indicar un agente oxidante sin especificar uno en particular escribiendo una ecuación con el símbolo [O] encima de la flecha. Por ejemplo, escribimos la oxidación del etanol, un alcohol primario, para formar acetaldehído, un aldehído, de la siguiente manera:
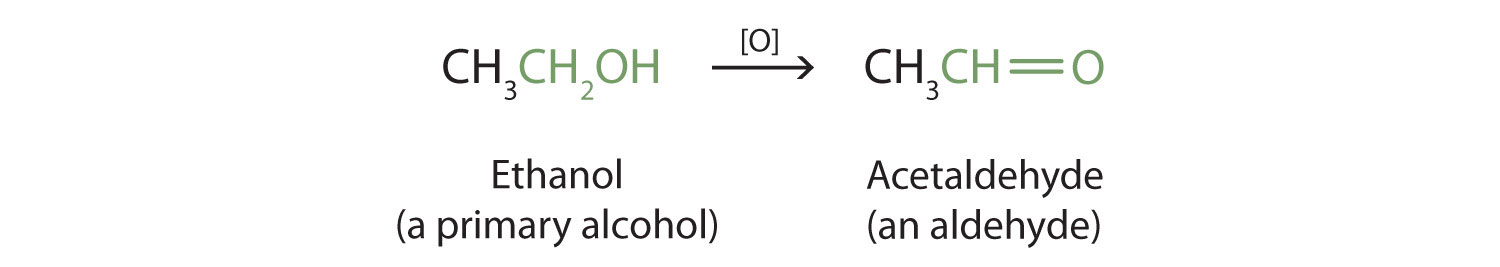
Veremos que los aldehídos se oxidan aún más fácilmente que los alcoholes y producen ácidos carboxílicos. Los alcoholes secundarios se oxidan a cetonas. La oxidación del alcohol isopropílico por dicromato de potasio (K 2 Cr 2 O 7) da acetona, la cetona más simple:

A diferencia de los aldehídos, las cetonas son relativamente resistentes a la oxidación adicional, por lo que no se requieren precauciones especiales para aislarlas a medida que se forman. Nótese que en la oxidación de alcoholes tanto primarios (RCH 2 OH) como secundarios (R 2 CHOH), se eliminan dos átomos de hidrógeno de la molécula de alcohol, uno del grupo OH y otro del átomo de carbono que porta el grupo OH.
Estas reacciones también se pueden llevar a cabo en el laboratorio con agentes oxidantes químicos. Uno de esos agentes oxidantes es el dicromato de potasio. La ecuación equilibrada (mostrando solo las especies involucradas en la reacción) en este caso es la siguiente:
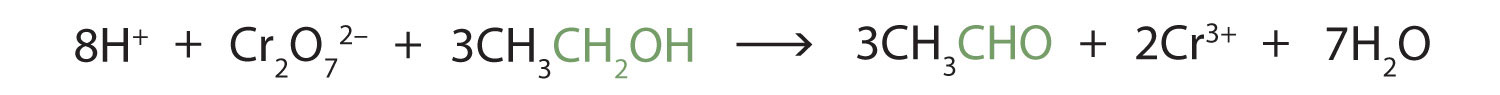
La oxidación del alcohol es importante en los organismos vivos. Las reacciones de oxidación controladas por enzimas proporcionan la energía que las células necesitan para realizar un trabajo útil. Un paso en el metabolismo de los carbohidratos implica la oxidación del grupo alcohol secundario en ácido isocitrico a un grupo cetona:
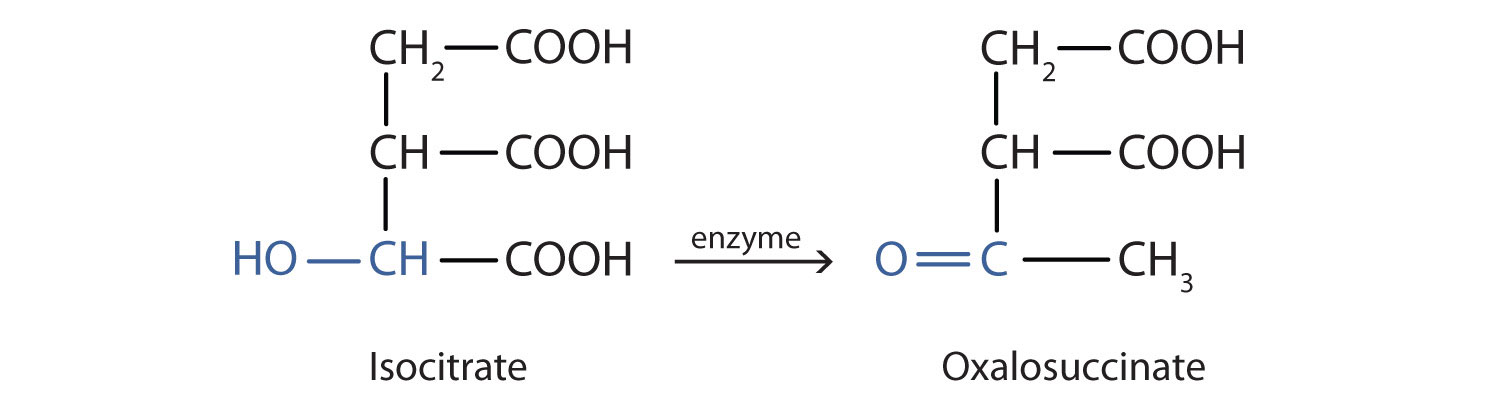
El tipo general de reacción es el mismo que en la conversión del alcohol isopropílico en acetona.
Los alcoholes terciarios (R 3 COH) son resistentes a la oxidación porque el átomo de carbono que lleva el grupo OH no tiene un átomo de hidrógeno unido sino que está unido a otros átomos de carbono. Las reacciones de oxidación que hemos descrito implican la formación de un doble enlace carbono-oxígeno. Así, el átomo de carbono que lleva el grupo OH debe ser capaz de liberar uno de sus átomos unidos para formar el doble enlace. El enlace carbono-hidrógeno se rompe fácilmente en condiciones oxidativas, pero los enlaces carbono-carbono no lo son. Por lo tanto los alcoholes terciarios no se oxidan fácilmente.
Escribir una ecuación para la oxidación de cada alcohol. Use [O] encima de la flecha para indicar un agente oxidante. Si no se produce ninguna reacción, escriba “no reacción” después de la flecha.
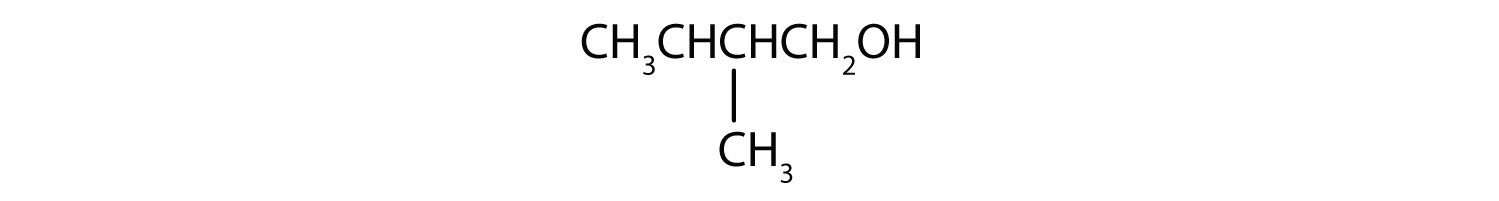
- CH 3 CH 2 CH 2 CH 2 CH 2 OH
-
-
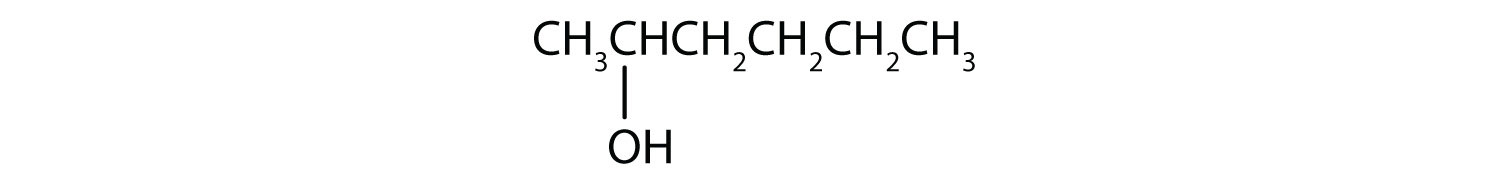
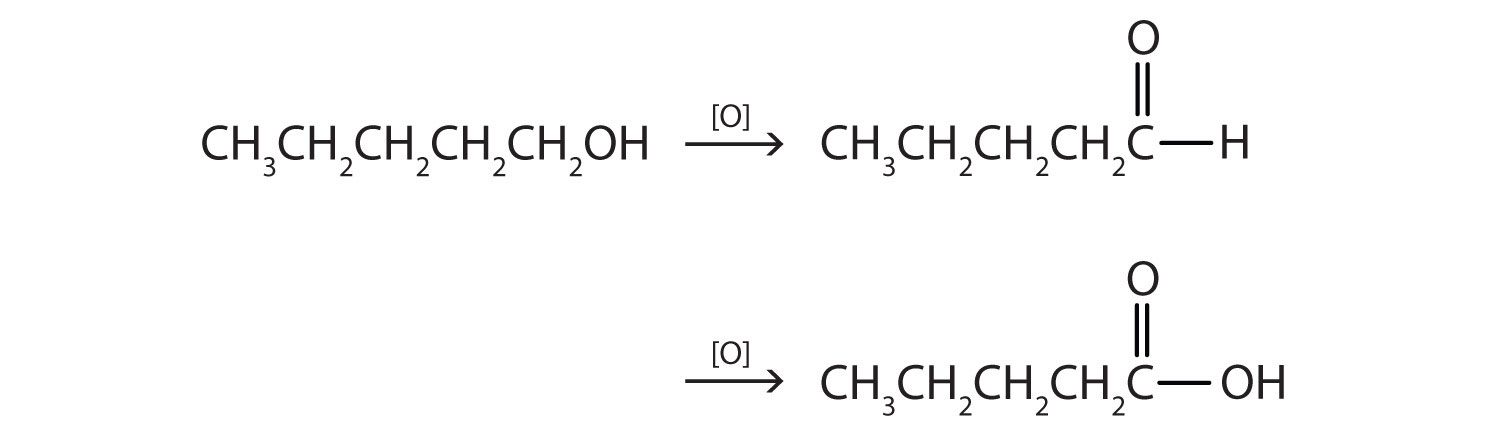
- Este alcohol tiene el grupo OH en un átomo de carbono que está unido solo a otro átomo de carbono, por lo que es un alcohol primario. La oxidación forma primero un aldehído y la oxidación adicional forma un ácido carboxílico.
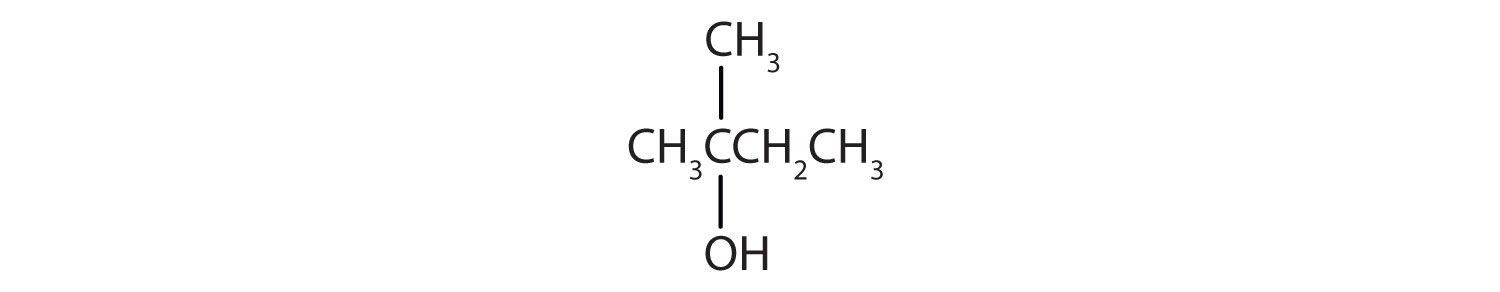
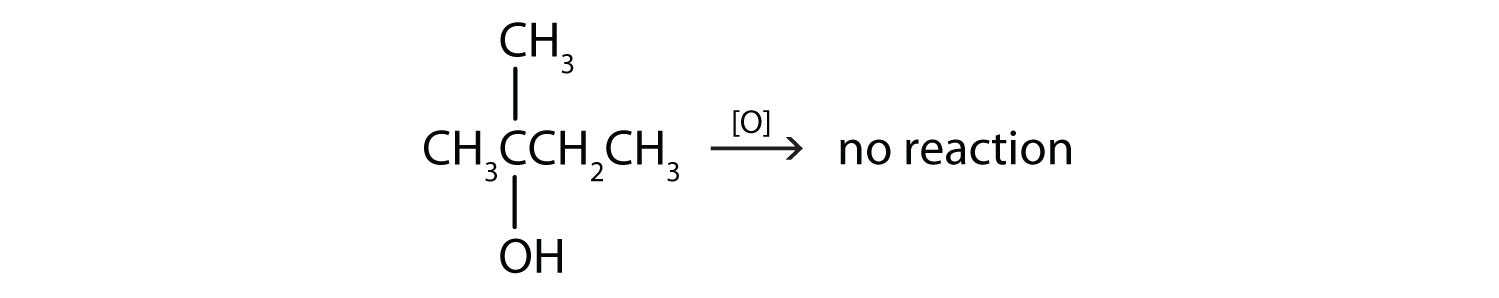
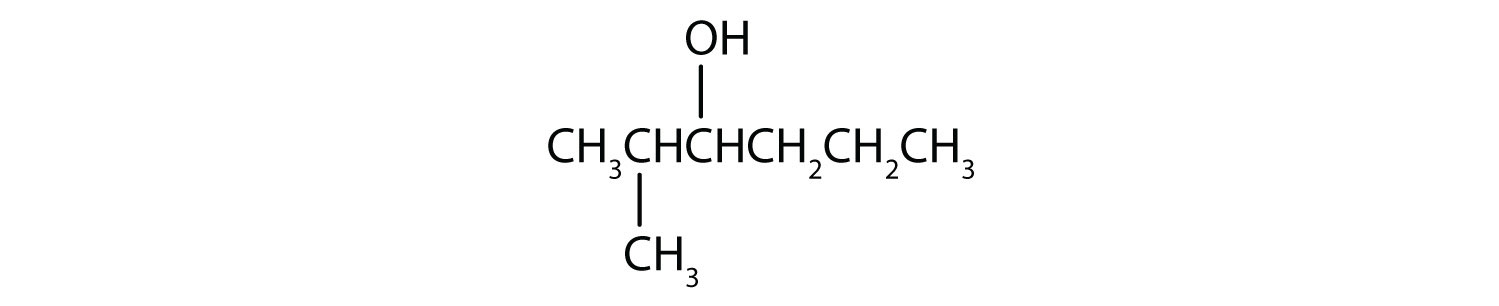
- Este alcohol tiene el grupo OH en un átomo de carbono que está unido a otros tres átomos de carbono, por lo que es un alcohol terciario. No se produce ninguna reacción.
- Este alcohol tiene el grupo OH en un átomo de carbono que está unido a otros dos átomos de carbono, por lo que es un alcohol secundario; la oxidación da una cetona.

-
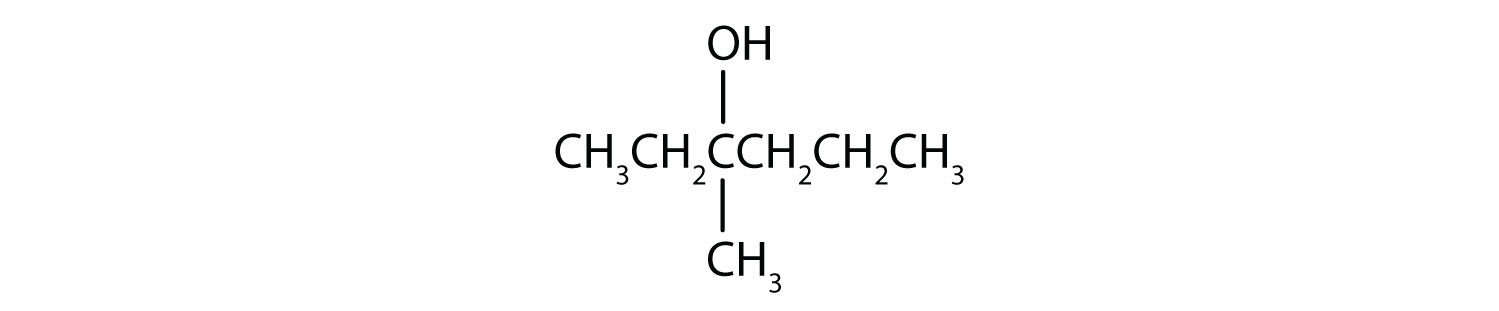
-
-
Solución
El primer paso es reconocer la clase de cada alcohol como primaria, secundaria o terciaria.
Escribir una ecuación para la oxidación de cada alcohol. Use [O] encima de la flecha para indicar un agente oxidante. Si no se produce ninguna reacción, escriba “no reacción” después de la flecha.
Resumen
Los alcoholes pueden deshidratarse para formar alquenos (temperatura más alta, exceso de ácido) o éteres (menor temperatura, exceso de alcohol). Los alcoholes primarios se oxidan para formar aldehídos. Los alcoholes secundarios se oxidan para formar cetonas. Los alcoholes terciarios no se oxidan fácilmente.

