14.7: Éteres
- Page ID
- 73395
- Describir la diferencia estructural entre un alcohol y un éter que afecta las características físicas y la reactividad de cada uno.
- Nombrar éteres simples.
- Describir la estructura y usos de algunos éteres.
Con la fórmula general ROR', un éter puede considerarse un derivado de agua en el que ambos átomos de hidrógeno están reemplazados por grupos alquilo o arilo. También puede considerarse un derivado de un alcohol (ROH) en el que el átomo de hidrógeno del grupo OH se ha reemplazado por un segundo grupo alquilo o arilo:
\[\mathrm{HOH\underset{H\: atoms}{\xrightarrow{replace\: both}}ROR'\underset{of\: OH\: group}{\xleftarrow{replace\: H\: atom}}ROH} \nonumber \]
Los éteres simples tienen nombres comunes simples, formados a partir de los nombres de los grupos unidos al átomo de oxígeno, seguidos del nombre genérico éter. Por ejemplo, CH 3 —O—CH 2 CH 2 CH 3 es metil propil éter. Si ambos grupos son iguales, el nombre del grupo debe ir precedido del prefijo di -, como en el éter dimetílico (CH 3 —O—CH 3) y el éter dietílico CH 3 CH 2 —O—CH 2 CH 3.
Las moléculas de éter no tienen átomo de hidrógeno en el átomo de oxígeno (es decir, ningún grupo OH). Por lo tanto, no hay enlaces de hidrógeno intermoleculares entre las moléculas de éter y, por lo tanto, los éteres tienen puntos de ebullición bastante bajos para una masa molar dada. En efecto, los éteres tienen puntos de ebullición aproximadamente los mismos que los de los alcanos de masa molar comparable y mucho menores que los de los alcoholes correspondientes (Tabla\(\PageIndex{1}\)).
| Fórmula estructural condensada | Nombre | Masa molar | Punto de ebullición (°C) | ¿Enlace de Hidrógeno Intermolecular en Líquido Puro? |
|---|---|---|---|---|
| CH 3 CH 2 CH 3 | propano | 44 | —42 | no |
| CH 3 OCH 3 | éter dimetílico | 46 | —25 | no |
| CH 3 CH 2 OH | alcohol etílico | 46 | 78 | si |
| CH 3 CH 2 CH 2 CH 2 CH 3 | pentano | 72 | 36 | no |
| CH 3 CH 2 OCH 2 CH 3 | éter dietílico | 74 | 35 | no |
| CH 3 CH 2 CH 2 CH 2 OH | alcohol butílico | 74 | 117 | si |
Sin embargo, las moléculas de éter tienen un átomo de oxígeno y participan en enlaces de hidrógeno con moléculas de agua. En consecuencia, un éter tiene aproximadamente la misma solubilidad en agua que el alcohol que es isomérico con él. Por ejemplo, el éter dimetílico y el etanol (ambos con la fórmula molecular C 2 H 6 O) son completamente solubles en agua, mientras que el éter dietílico y el 1-butanol (ambos C 4 H 10 O) son apenas solubles en agua (8 g/100 mL de agua).
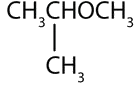
¿Cuál es el nombre común para cada éter?
- CH 3 CH 2 CH 2 OCH 2 CH 2 CH 3
-
Solución
- Los grupos de carbono a cada lado del átomo de oxígeno son grupos propilo (CH 3 CH 2 CH 2), por lo que el compuesto es éter dipropílico.
- El grupo de tres carbonos está unido por el átomo de carbono medio, por lo que es un grupo isopropilo. El grupo de un carbono es un grupo metilo. El compuesto es éter isopropílico metílico.
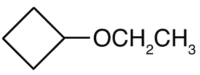
¿Cuál es el nombre común para cada éter?
-
CH 3 CH 2 CH 2 CH 2 CH 2 CH 2 CH 2 CH 3
Un anestésico general actúa sobre el cerebro para producir inconsciencia y una insensibilidad general a la sensación o al dolor. El éter dietílico (CH 3 CH 2 OCH 2 CH 3) fue el primer anestésico general que se utilizó.
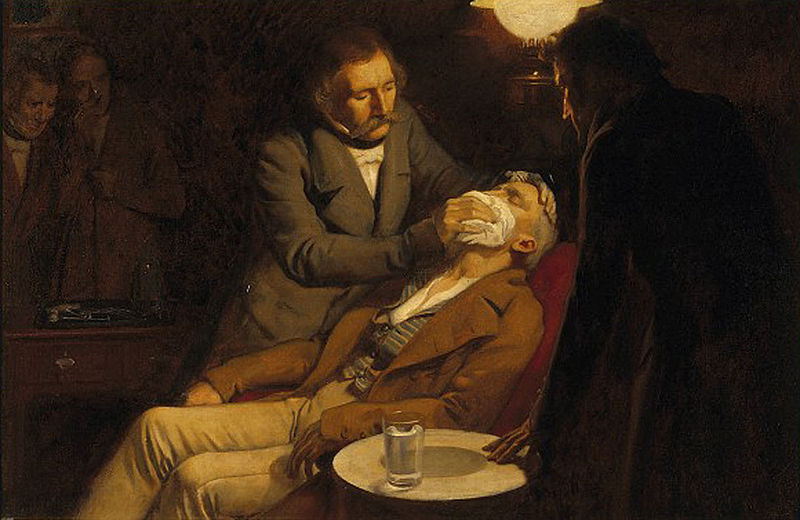
El éter dietílico es relativamente seguro porque existe una brecha bastante amplia entre la dosis que produce un nivel efectivo de anestesia y la dosis letal. Sin embargo, debido a que es altamente inflamable y tiene la desventaja añadida de causar náuseas, ha sido reemplazada por anestésicos inhalantes más nuevos, incluyendo los compuestos que contienen flúor haloetano, enflurano e isoflurano. Desafortunadamente, se ha cuestionado la seguridad de estos compuestos para el personal de quirófano. Por ejemplo, las trabajadoras de quirófano expuestas al haloetano sufren una mayor tasa de abortos espontáneos que las mujeres de la población general.
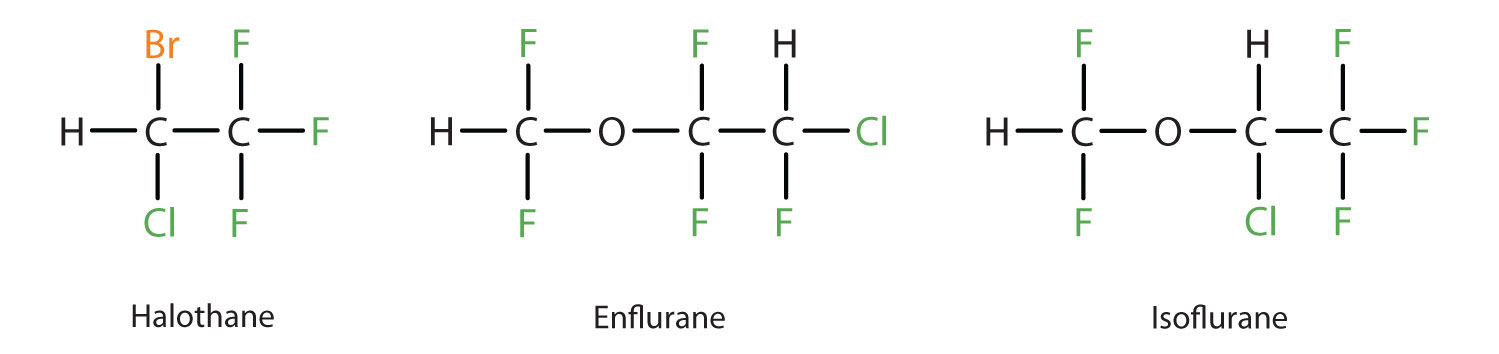
Estos tres compuestos anestésicos modernos, inhalantes, que contienen halógenos, son menos inflamables que el éter dietílico.
Resumen
Para dar nombres comunes a los éteres, simplemente nombra los grupos unidos al átomo de oxígeno, seguido del nombre genérico éter. Si ambos grupos son iguales, el nombre del grupo debe ir precedido por el prefijo di -. Las moléculas de éter no tienen grupo OH y por lo tanto no tienen enlaces de hidrógeno intermoleculares. Por lo tanto, los éteres tienen puntos de ebullición bastante bajos para una masa molar dada. Las moléculas de éter tienen un átomo de oxígeno y pueden participar en enlaces de hidrógeno con moléculas de agua. Una molécula de éter tiene aproximadamente la misma solubilidad en agua que el alcohol que es isomérica con ella.

