15.3: Propiedades de Aldehídos y Cetonas
- Page ID
- 73508
- Explicar por qué los puntos de ebullición de aldehídos y cetonas son mayores que los de éteres y alcanos de masas molares similares pero menores que los de alcoholes comparables.
- Comparar las solubilidades en agua de aldehídos y cetonas de cuatro o menos átomos de carbono con las solubilidades de alcanos y alcoholes comparables.
- Nombrar las reacciones típicas que se llevan a cabo con aldehídos y cetonas.
- Describir algunos de los usos de aldehídos y cetonas comunes.
El doble enlace carbono-oxígeno es bastante polar, más polar que un enlace sencillo carbono-oxígeno. El átomo de oxígeno electronegativo tiene una atracción mucho mayor para los pares de electrones de unión que el átomo de carbono. El átomo de carbono tiene una carga positiva parcial, y el átomo de oxígeno tiene una carga negativa parcial:
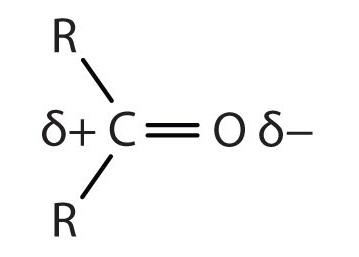
En aldehídos y cetonas, esta separación de carga conduce a interacciones dipolo-dipolo que son lo suficientemente grandes como para afectar significativamente los puntos de ebullición. El cuadro\(\PageIndex{1}\) muestra que los enlaces simples polares en los éteres tienen poco efecto, mientras que los enlaces de hidrógeno entre las moléculas de alcohol son aún más fuertes.
| Compuesto | Familia | Masa molar | Tipo de Fuerzas Intermoleculares | Punto de ebullición (°C) |
|---|---|---|---|---|
| CH 3 CH 2 CH 2 CH 3 | alcano | 58 | dispersión solamente | —1 |
| CH 3 OCH 2 CH 3 | éter | 60 | dipolo débil | 6 |
| CH 3 CH 2 CHO | aldehido | 58 | dipolo fuerte | 49 |
| CH 3 CH 2 CH 2 OH | alcohol | 60 | enlaces de hidrógeno | 97 |
El formaldehído es un gas a temperatura ambiente. El acetaldehído hierve a 20°C; en un recipiente abierto, hierve en una habitación cálida. La mayoría de los otros aldehídos comunes son líquidos a temperatura ambiente.
Aunque los miembros inferiores de la serie homóloga tienen olores picantes, muchos aldehídos superiores tienen olores agradables y se utilizan en perfumes y saborizantes artificiales. En cuanto a las cetonas, la acetona tiene un olor agradable, pero la mayoría de los homólogos superiores tienen olores bastante suaves.
El átomo de oxígeno del grupo carbonilo se acopla en enlaces de hidrógeno con una molécula de agua.

Por lo tanto, la solubilidad de los aldehídos es aproximadamente la misma que la de los alcoholes y éteres. Formaldehído, acetaldehído y acetona son solubles en agua. A medida que la cadena de carbono aumenta en longitud, la solubilidad en agua disminuye. El límite de solubilidad se produce en aproximadamente cuatro átomos de carbono por átomo de oxígeno. Todos los aldehídos y cetonas son solubles en disolventes orgánicos y, en general, son menos densos que el agua.
Oxidación de aldehídos y cetonas
Los aldehídos y cetonas son muy parecidos en muchas de sus reacciones, debido a la presencia del grupo funcional carbonilo en ambas. Se diferencian mucho, sin embargo, en un tipo de reacción más importante: la oxidación. Los aldehídos se oxidan fácilmente a ácidos carboxílicos, mientras que las cetonas resisten la oxidación.

Los aldehídos se encuentran, de hecho, entre los compuestos orgánicos más fácilmente oxidados. Se oxidan por el oxígeno (O 2) en el aire a ácidos carboxílicos.
\[2RCHO + O_2 \rightarrow 2RCOOH \label{14.10.1} \]
La facilidad de oxidación ayuda a los químicos a identificar aldehídos. Un agente oxidante suficientemente suave puede distinguir los aldehídos no solo de las cetonas sino también de los alcoholes. El reactivo de Tollens, por ejemplo, es una solución alcalina de ion plata (Ag +) complejado con amoníaco (NH 3), que mantiene el ion Ag + en solución.
\[H_3N—Ag^+—NH_3 \label{14.10.2} \]
Cuando el reactivo Tollens oxida un aldehído, el ion Ag + se reduce a plata libre (Ag).
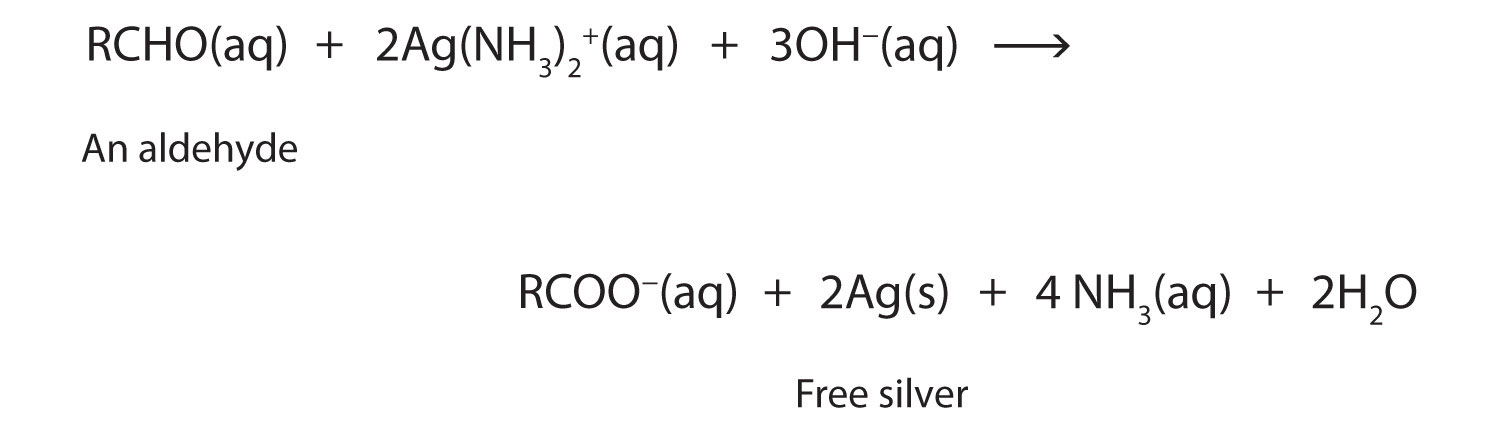
Depositada sobre una superficie de vidrio limpia, la plata produce un espejo (Figura\(\PageIndex{1}\)). Las cetonas ordinarias no reaccionan con el reactivo de Tollens.

Aunque las cetonas resisten la oxidación por agentes oxidantes ordinarios de laboratorio, se someten a combustión, al igual que los aldehídos.
Resumen
El doble enlace polar carbono-oxígeno hace que los aldehídos y cetonas tengan puntos de ebullición más altos que los de éteres y alcanos de masas molares similares pero menores que los de alcoholes comparables que se involucran en enlaces de hidrógeno intermoleculares. Los aldehídos se oxidan fácilmente a ácidos carboxílicos, mientras que las cetonas resisten la oxidación.

