17.2: Acidez de los ácidos carboxílicos
- Page ID
- 72827
- Defínelo\(pK_a\) y utilícelo para determinar la acidez de diferentes ácidos carboxílicos.
- Describir las reacciones entre ácidos carboxílicos y bases fuertes.
Ionización de Ácidos Carboxílicos
Los ácidos carboxílicos se denominan así porque tienden a ser más ácidos que otros grupos funcionales en la química orgánica. En soluciones acuosas diluidas, actúan como ácidos débiles que se disocian parcialmente para producir el anión carboxilato y el catión hidronio correspondientes (H 3 O +). Los aniones carboxilato se nombran reemplazando el ácido - ic que termina del ácido carboxílico por - ate, ver ejemplos a continuación.
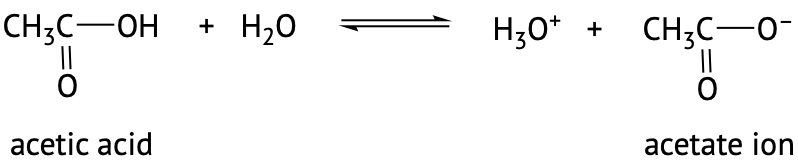
El grado de disociación de estos ácidos débiles en el agua se describe por\(K_a\) valores. Recuerda que un compuesto con un\(K_a\) valor menor será un ácido más débil.
\({RCOOH+H_2O\rightleftharpoons RCOO^-+H_3O^+}\)\(K_a = \dfrac{[\ce{RCOO^{-}}][\ce{H3O^{+}}]}{[\ce{RCOOH}]}\)
Al comparar la acidez de orgánicas y biomoléculas, es útil (y más preferible) usar\(pK_a\) valores en lugar de\(K_a\) valores, los cuales se calculan tomando el log negativo de\(K_a\):\(pK_a =\ –\log K_a\). Al usar la\(pK_a\) escala, es importante saber que los ácidos más débiles tienen\(pK_a\) valores mayores y más positivos, esto es opuesto a los\(K_a\) valores. Los\(pK_a\) valores de algunos ácidos carboxílicos típicos se listan en la Tabla\(\PageIndex{1}\). (Recuerde que\(pK_a\) es una expresión logarítmica, lo que significa que cada 1\(pK_a\) unidad representa un cambio de 10 veces en la acidez).
| Nombre | Compuesto | \(K_a\) | \(pK_a\) |
|---|---|---|---|
| ácido fórmico | HCOOH | \ (K_a\)” style="text-align:center; ">1.8 X 10 —4 | \ (PK_a\)” style="text-align:center; ">3.74 |
| ácido acético | CH 3 COOH | \ (K_a\)” style="text-align:center; ">1.8 X 10 —5 | \ (PK_a\)” style="text-align:center; ">4.74 |
| ácido propanoico | CH 3 CH 2 COOH | \ (K_a\)” style="text-align:center; ">1.3 X 10 —5 | \ (PK_a\)” style="text-align:center; ">4.89 |
| ácido butanoico | CH 3 CH 2 CH 2 COOH | \ (K_a\)” style="text-align:center; ">1.5 X 10 —5 | \ (PK_a\)” style="text-align:center; ">4.82 |
| ácido cloroacético | CLch 2 COOH | \ (K_a\)” style="text-align:center; ">1.4 X 10 —3 | \ (PK_a\)” style="text-align:center; ">2.85 |
| ácido tricloroacético | Cl 3 CCOOH | \ (K_a\)” style="text-align:center; ">2.3 X 10 —1 | \ (PK_a\)” style="text-align:center; ">0.64 |
| ácido hexanoico | CH 3 (CH 2) 4 COOH | \ (K_a\)” style="text-align:center; ">1.3 X 10 —5 | \ (PK_a\)” style="text-align:center; ">4.89 |
| ácido benzoico | C 6 H 5 COOH | \ (K_a\)” style="text-align:center; ">6.5 X 10 —5 | \ (PK_a\)” style="text-align:center; ">4.19 |
| ácido oxálico | HOOCCOOH | \ (K_a\)” style="text-align:center; ">5.4 X 10 —2 | \ (PK_a\)” style="text-align:center; ">1.27 |
| — OOCCOOH | \ (K_a\)” style="text-align:center; ">5.2 X 10 —5 | \ (PK_a\)” style="text-align:center; ">4.28 | |
| ácido glutárico | HOOC (CH 2) 3 COOH | \ (K_a\)” style="text-align:center; ">4.5 X 10 —5 | \ (PK_a\)” style="text-align:center; ">4.35 |
| — OOC (CH 2) 3 COOH | \ (K_a\)” style="text-align:center; ">3.8 X 10 —6 | \ (PK_a\)” style="text-align:center; ">5.42 |
Neutralización de Ácidos Carboxílicos
Los ácidos carboxílicos reaccionarán con bases tales como hidróxido de sodio (NaOH), carbonato de sodio (Na 2 CO 3) y bicarbonato de sodio (NaHCO 3) para formar agua y una sal de ácido carboxílico:
RCOOH + NaOH (ac) → RCOO − Na + (aq) + H 2 O
2RCOOH + Na 2 CO 3 (aq) → 2RCOO − Na + (aq) + H 2 O + CO 2 (g)
RCOOH + NaHCO 3 (ac) → RCOO − Na + (aq) + H 2 O + CO 2 (g)
En estas reacciones, los ácidos carboxílicos actúan como ácidos inorgánicos: neutralizan los compuestos básicos. Con soluciones de iones carbonato (\(CO_3^{2–}\)) y bicarbonato (\(HCO_3^{–}\)), también forman gas dióxido de carbono.
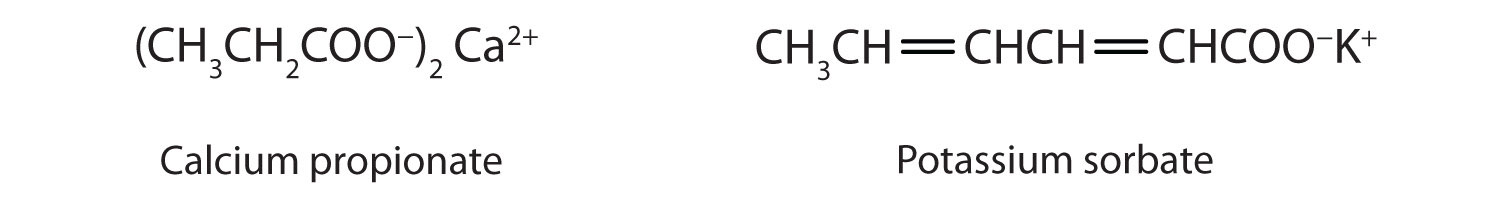
Las sales de ácidos carboxílicos se nombran de la misma manera que las sales inorgánicas: el nombre del catión va seguido del nombre del anión orgánico. El nombre del anión se obtiene dejando caer el final - ic del nombre ácido y reemplazándolo con el sufijo - ate. Esta regla se aplica tanto si estamos usando nombres comunes como nombres de la Unión Internacional de Química Pura y Aplicada (IUPAC):

Las sales de los ácidos carboxílicos de cadena larga se llaman jabones.
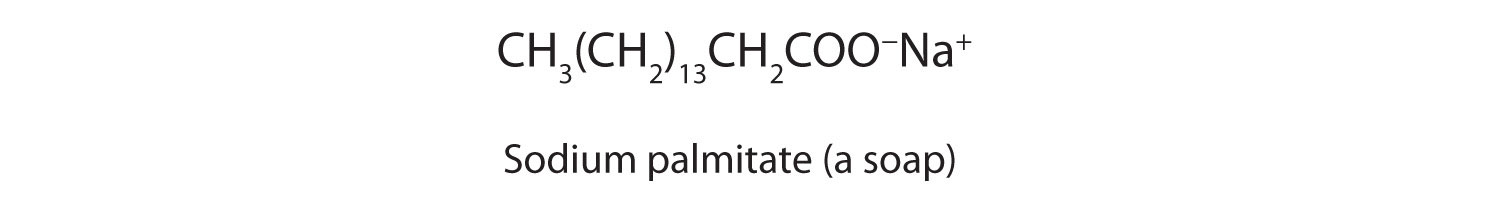
Escribe una ecuación para cada reacción.
- la ionización del ácido propiónico en agua (H 2 O)
- la neutralización del ácido propiónico con hidróxido de sodio acuoso (NaOH)
Solución
El ácido propiónico tiene tres átomos de carbono, por lo que su fórmula es CH 2 CH 2 COOH.
- El ácido propiónico se ioniza en agua para formar un ion propionato y un ion hidronio (H 3 O +). CH 3 CH 2 COOH (aq) + H 2 O (l) → CH 3 CH 2 COO − (aq) + H 3 O + (aq)
- El ácido propiónico reacciona con NaOH (ac) para formar propionato de sodio y agua. CH 3 CH 2 COOH (ac) + NaOH (ac) → CH 3 CH 2 COO − Na + (aq) + H 2 O (l)
Escribe una ecuación para cada reacción.
- la ionización de ácido fórmico en agua
- la ionización del ácido p-clorbenzoico en agua
Escribir una ecuación para la reacción del ácido decanoico con cada compuesto.
- hidróxido de sodio acuoso (NaOH)
- bicarbonato de sodio acuoso (NaHCO 3)
Solución
- El ácido decanoico tiene 10 átomos de carbono. Reacciona con NaOH para formar una sal y agua (H 2 O). CH 3 (CH 2) 8 COOH + NaOH (ac) → CH 3 (CH 2) 8 COO − Na + (aq) + H 2 O (l)
- Con NaHCO 3, los productos son una sal, H 2 O, y dióxido de carbono (CO 2). CH 3 (CH 2) 8 COOH + NaHCO 3 (aq) → CH 3 (CH 2) 8 COO − Na + (aq) + H 2 O (l) + CO 2 (g)
Escribir una ecuación para la reacción del ácido benzoico con cada compuesto.
- hidróxido de sodio acuoso (NaOH)
- bicarbonato de sodio acuoso (NaHCO 3)
Algunas sales orgánicas se utilizan como conservantes en los productos alimenticios. Previenen el deterioro al inhibir el crecimiento de bacterias y hongos. Se agrega calcio y propionato de sodio, por ejemplo, al queso procesado y productos de panadería; se agrega benzoato de sodio a la sidra, jaleas, encurtidos y jarabes; y sorbato de sodio y sorbato de potasio se agregan a los jugos de frutas, chucrut, refrescos y vino. Búscalos en las etiquetas de ingredientes la próxima vez que compres comestibles.