17.4: Hidrólisis de Ésteres y Amidas
- Page ID
- 72828
- Describir la reacción típica que tiene lugar con los ésteres.
- Identificar los productos de una hidrólisis ácida de un éster.
- Identificar los productos de una hidrólisis básica de un éster.
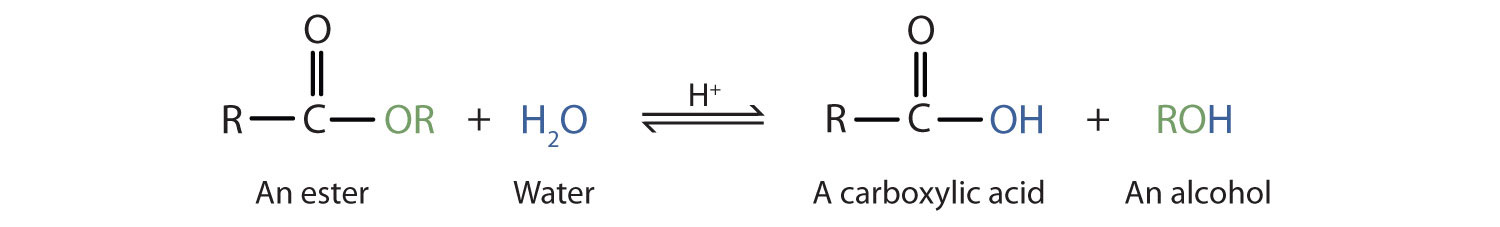
Los ésteres son compuestos neutros, a diferencia de los ácidos a partir de los cuales se forman. En reacciones típicas, el grupo alcoxi (OR') de un éster se reemplaza por otro grupo. Una de esas reacciones es la hidrólisis, literalmente “dividiéndose con agua”. La hidrólisis de ésteres es catalizada por un ácido o una base.
La hidrólisis ácida es simplemente lo contrario de la esterificación. El éster se calienta con un gran exceso de agua que contiene un catalizador ácido fuerte. Al igual que la esterificación, la reacción es reversible y no llega a su finalización.
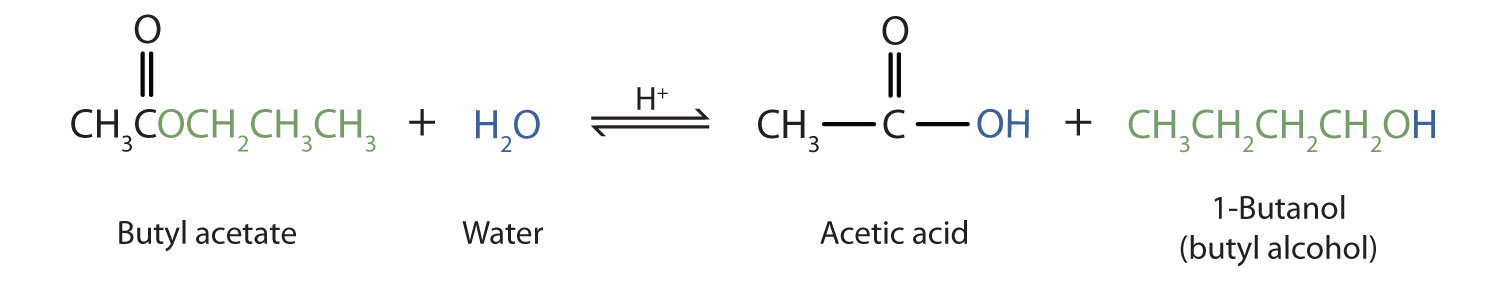
Como ejemplo específico, el acetato de butilo y el agua reaccionan para formar ácido acético y 1-butanol. La reacción es reversible y no llega a su finalización.
Escribe una ecuación para la hidrólisis ácida del butirato de etilo (CH 3 CH 2 CH 2 COOCH 2 CH 3) y nombra los productos.
Solución
Recuerde que en la hidrólisis ácida, el agua (HOH) divide el enlace éster. El H de HOH se une al átomo de oxígeno en la parte OR del éster original, y el OH de HOH se une al átomo de carbono del carbonilo:
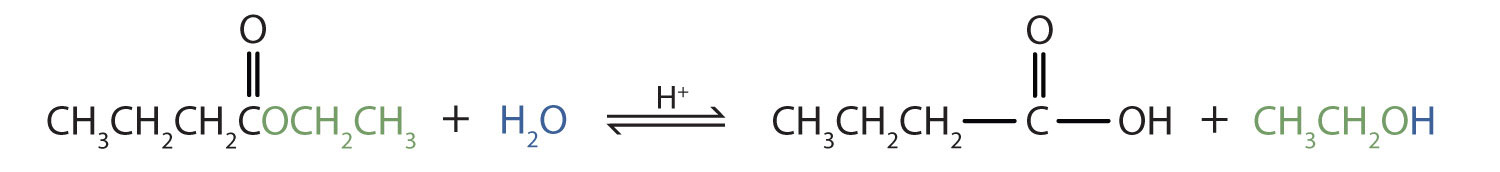
Los productos son ácido butírico (ácido butanoico) y etanol.
Escribe una ecuación para la hidrólisis ácida del butanoato de metilo y nombra los productos.
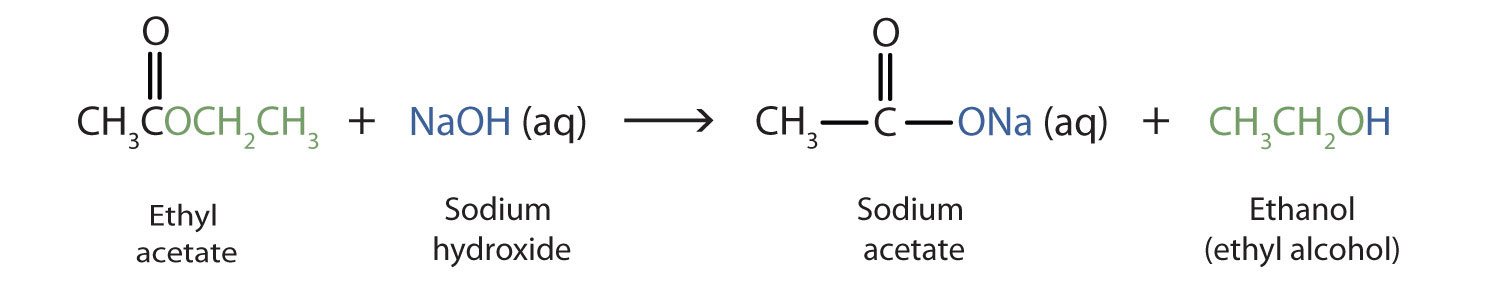
Cuando se usa una base (como hidróxido de sodio [NaOH] o hidróxido de potasio [KOH]) para hidrolizar un éster, los productos son una sal carboxilato y un alcohol. Debido a que los jabones se preparan mediante la hidrólisis alcalina de grasas y aceites, la hidrólisis alcalina de los ésteres se llama saponificación (sapón latino, que significa “jabón”, y facere, que significa “hacer”). En una reacción de saponificación, la base es un reactivo, no simplemente un catalizador. La reacción va a su finalización:
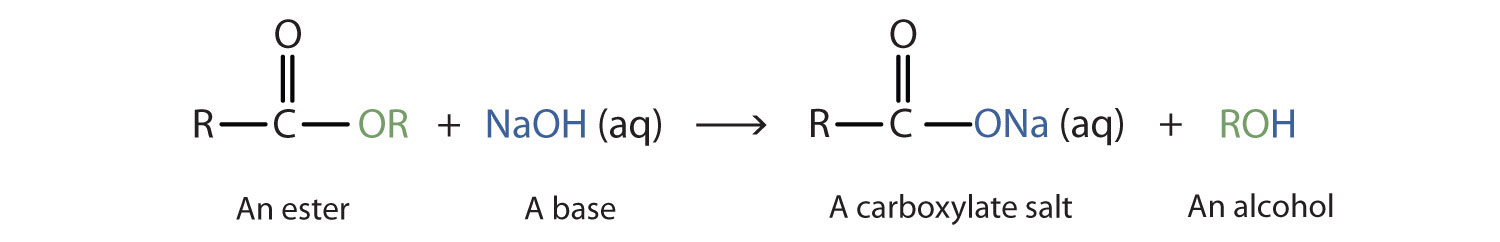
Como ejemplo específico, el acetato de etilo y el NaOH reaccionan para formar acetato de sodio y etanol:
Escribir una ecuación para la hidrólisis de benzoato de metilo en una solución de hidróxido de potasio.
Solución
En la hidrólisis básica, la molécula de la base divide el enlace éster. La porción ácida del éster termina como la sal del ácido (en este caso, la sal de potasio). La porción de alcohol del éster termina como el alcohol libre.
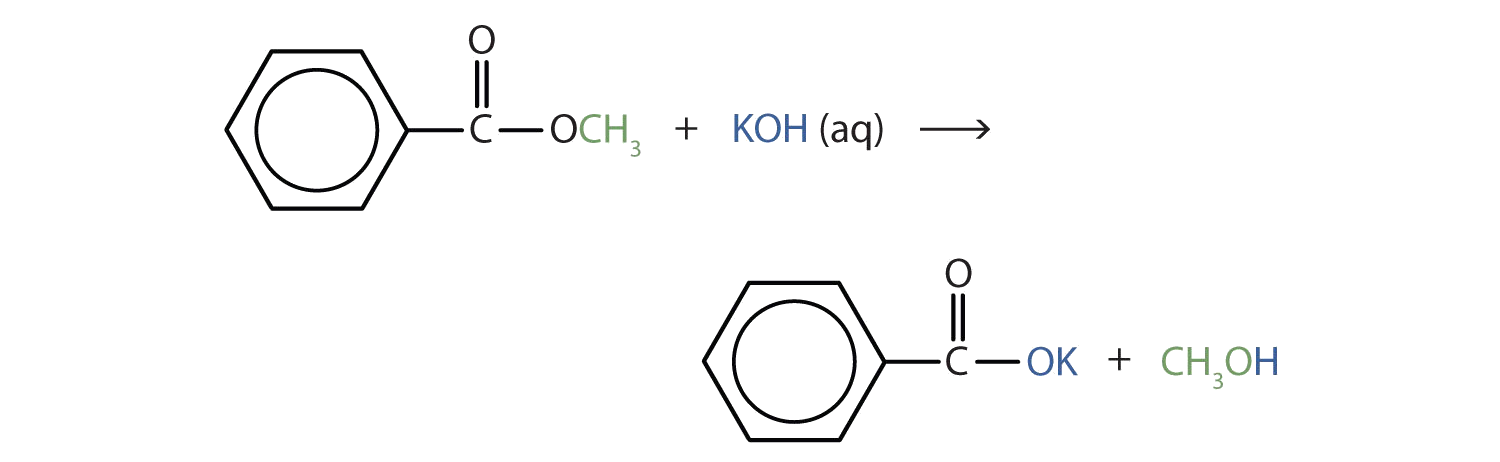
Escribir la ecuación para la hidrólisis de propanoato de etilo en una solución de hidróxido de sodio.
Hidrólisis de Amidas
Generalmente, las amidas resisten la hidrólisis en agua corriente, incluso después de un calentamiento prolongado. Sin embargo, en presencia de ácido o base añadidos, la hidrólisis procede a una velocidad moderada. En las células vivas, la hidrólisis de amida es catalizada por enzimas. La hidrólisis de amida se ilustra en el siguiente ejemplo:

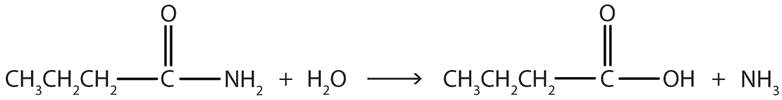
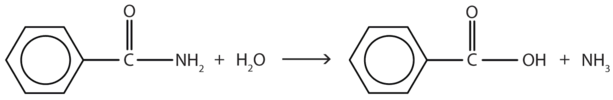
La hidrólisis de una amida en solución ácida da realmente un ácido carboxílico y la sal de amoníaco o una amina (el amoníaco o amina inicialmente formado es neutralizado por el ácido). La hidrólisis básica da una sal del ácido carboxílico y amoníaco o una amina.
Escribe la ecuación para la hidrólisis de cada compuesto.
- butiramida
- benzamida
Solución
- La hidrólisis de una amida simple produce un ácido orgánico y amoníaco. Por lo tanto, la butiramida produce ácido butírico y amoníaco.
Escribe la ecuación para la hidrólisis de cada compuesto.
- propionamida (propanamida)
- hexanamida
El entrenamiento atlético es una profesión aliada del cuidado de la salud reconocida por la Asociación Médica Americana. El papel del entrenador atlético es reconocer, evaluar y brindar atención inmediata para las lesiones atléticas; prevenir lesiones atléticas grabando, vendando y fortaleciendo partes vulnerables del cuerpo; hacer derivaciones a médicos cuando sea necesario; y rehabilitar a los atletas lesionados. Los entrenadores atléticos trabajan en escuelas secundarias, colegios y otras organizaciones donde se encuentran programas de atletismo. Los entrenadores atléticos generalmente tienen un título de un programa de entrenamiento atlético acreditado cuyo plan de estudios incluye cursos de ciencias básicas como biología, química y física. Estos estudios proporcionan los antecedentes necesarios para cursos más aplicados, como anatomía y fisiología, fisiología del ejercicio, kinesiología y nutrición. El conocimiento de la química es necesario para comprender la terminología farmacológica y médica. Por ejemplo, los entrenadores atléticos deben entender la acción de numerosas drogas, muchas de las cuales son ésteres, aminas o amidas como las mencionadas en este capítulo.
Los entrenadores atléticos pueden tener deberes administrativos, como la responsabilidad de ordenar suministros. También necesitan poder evaluar los suplementos nutricionales porque proporcionar el equivocado puede hacer que un atleta sea expulsado de la competencia y puede traer sanciones contra una escuela. En definitiva, el entrenador atlético es responsable de la salud y bienestar general de los atletas a su cargo.
Resumen
La hidrólisis es una reacción de lo más importante de los ésteres. La hidrólisis ácida de un éster da un ácido carboxílico y un alcohol. La hidrólisis básica de un éster da una sal carboxilato y un alcohol.

