18.3: Aminoácidos
- Page ID
- 73142
- Reconocer los aminoácidos y clasificarlos en función de las características de sus cadenas laterales.
- Identificar qué aminoácidos son quirales.
Las proteínas en todas las especies vivas, desde bacterias hasta humanos, son polímeros construidos a partir del mismo conjunto de 20 aminoácidos. Los humanos pueden sintetizar solo alrededor de la mitad de los aminoácidos necesarios; el resto debe obtenerse de la dieta y se conocen como aminoácidos esenciales. Sin embargo, se han encontrado dos aminoácidos adicionales en cantidades limitadas en proteínas: La selenocisteína se descubrió en 1986, mientras que la pirrolisina se descubrió en 2002.
Estructura de aminoácidos
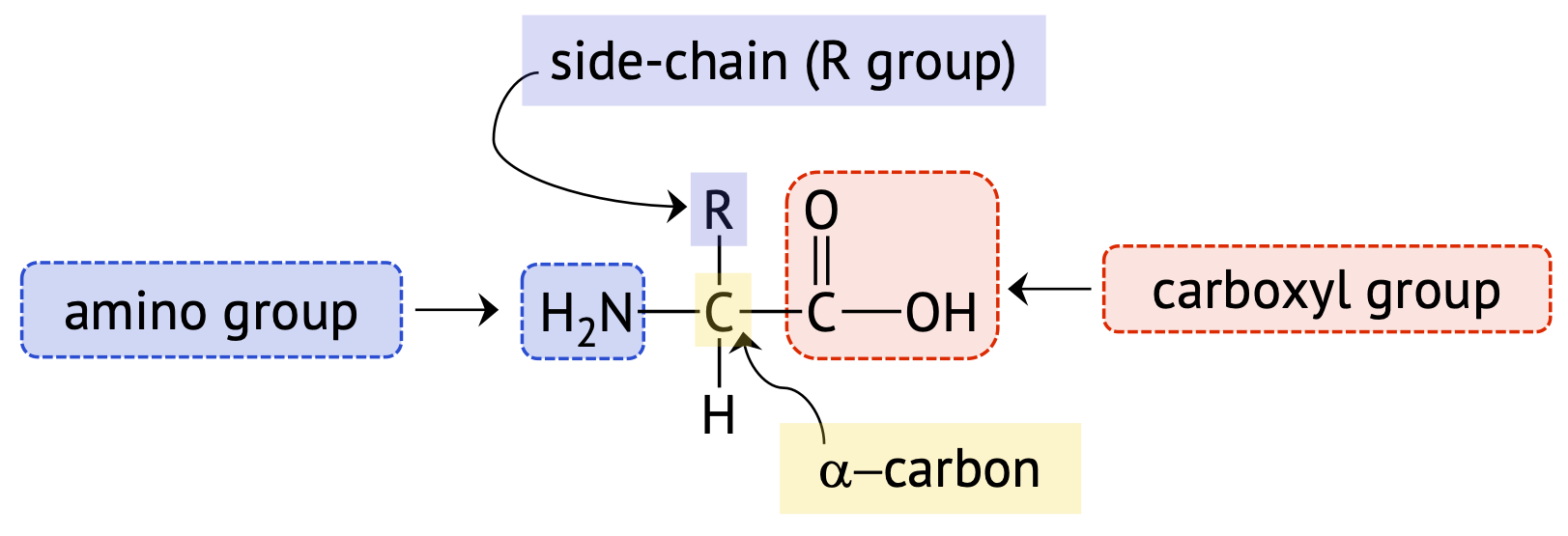
Cada aminoácido contiene un grupo amino, (—NH 2), un grupo carboxilo, (—COOH) y una cadena lateral o grupo R, que están todos unidos al carbono alfa (\(\alpha\)-) (el que está unido directamente al grupo funcional carboxilo). Por lo tanto, los aminoácidos se denominan comúnmente alfa-amino (\(\alpha\)-amino) ácidos. La\(\PageIndex{1}\) siguiente figura muestra la estructura de un\(\alpha\) aminoácido genérico.
Cadenas laterales de aminoácidos
Las cadenas laterales de aminoácidos o grupos R pueden variar desde un solo átomo de hidrógeno (como en glicina), hasta una cadena de hidrocarburo simple, hasta un hidrocarburo que contiene un grupo funcional. Cada grupo R tiene diferencias en tamaño, forma, solubilidad y propiedades de ionización, lo que contribuye a las propiedades únicas de un aminoácido individual, y puede tener un efecto sobre la estructura y función general de una proteína.
La\(\PageIndex{1}\) siguiente tabla enumera los 20 aminoácidos comunes junto con sus nombres, sus códigos de tres y una letra, estructuras y características distintivas. Los códigos de tres letras son generalmente las tres primeras letras del nombre del aminoácido excepto en algunos casos, como isoleucina (Ile) y triptófano (Trp). Del mismo modo, el código de una letra suele ser la primera letra en el nombre del aminoácido, pero donde la letra no es única, se usa una letra que es fonéticamente similar al nombre del aminoácido: F para F enilalanina, R para una ginina R y W para t W iptófano. Esta tabla también agrupa los aminoácidos según si la cadena lateral a pH neutro es no polar, polar no cargada, cargada positivamente o cargada negativamente.
| Nombre común | Código de tres letras (una letra) | Nombre Sistemático (IUPAC) | Fórmula estructural (a pH 6) | Punto isoeléctrico (pI) | Característica distintiva |
|---|---|---|---|---|---|
| Aminoácidos con un grupo R no polar | |||||
| glicina | Gly (G) | ácido aminoetanoico | 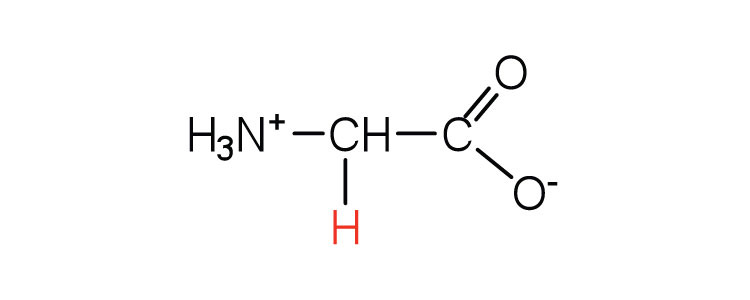 |
6.0 | el único aminoácido que carece de carbono quiral |
| alanina | Ala (A) | Ácido 2-aminopropanoico | 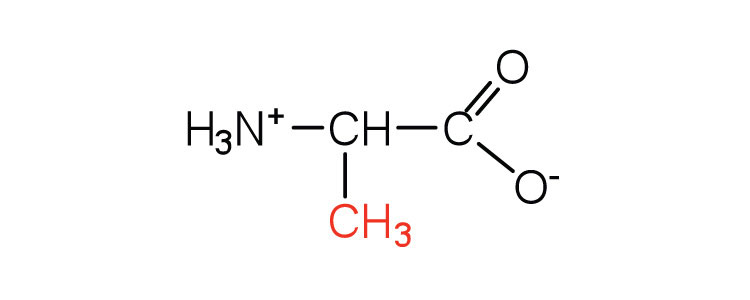 |
6.0 | un grupo metilo, es la segunda cadena lateral más pequeña |
| valina | Val (V) | Ácido 2-amino-3-metilbutanoico | 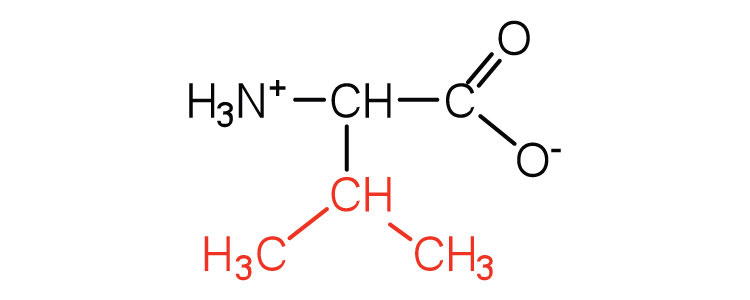 |
6.0 | un aminoácido de cadena ramificada |
| leucina | Leu (L) | Ácido 2-amino-4-metilpentanoico | 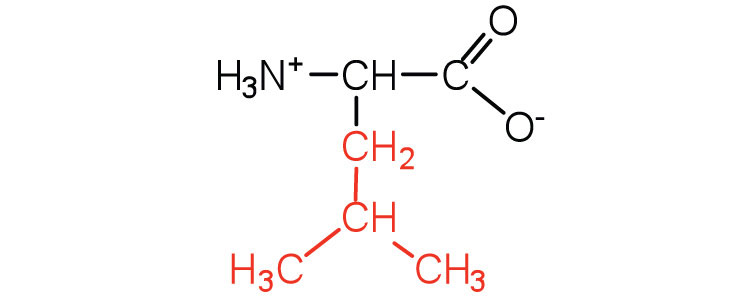 |
6.0 | un aminoácido de cadena ramificada |
| isoleucina | Ile (I) | Ácido 2-amino-3-metilpentanoico | 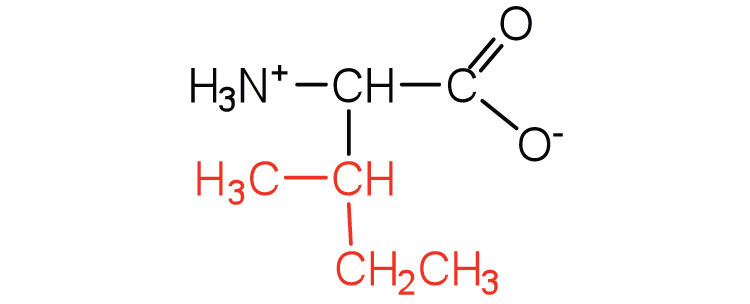 |
6.0 | un aminoácido esencial porque la mayoría de los animales no pueden sintetizar aminoácidos de cadena ramificada |
| fenilalanina | Phe (F) | Ácido 2-amino-3-fenilpropanoico | 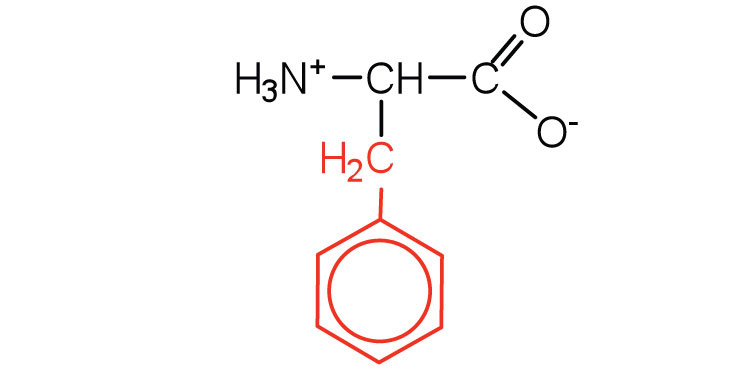 |
5.5 | también clasificado como un aminoácido aromático |
| triptófano | Trp (W) | Ácido 2-amino-3- (1H-indol-3-il) -propanoico | 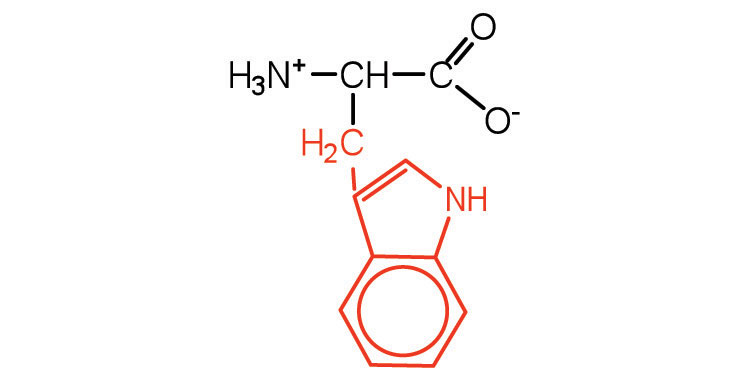 |
5.9 | también clasificado como un aminoácido aromático |
| metionina | Met (M) | Ácido 2-amino-4- (metiltio) butanoico | 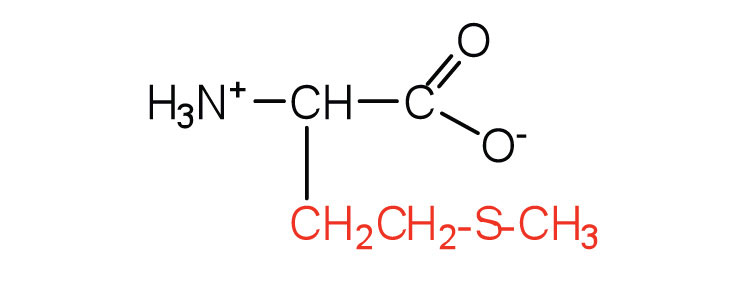 |
5.7 | funciones de la cadena lateral como donante del grupo metilo |
| prolina | Pro (P) | ácido pirrolidin-2-carboxílico | 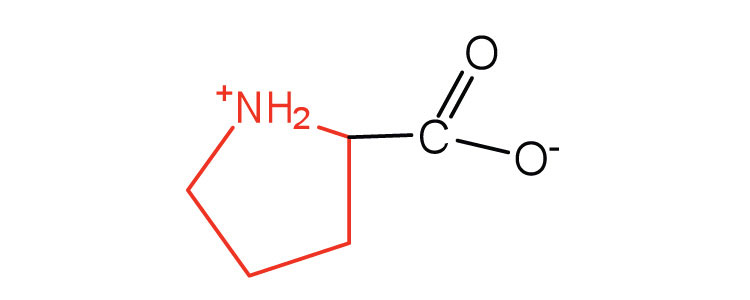 |
6.3 | contiene un grupo amina secundaria; denominado ácido α-imino |
| Aminoácidos con un grupo R polar pero neutro | |||||
| serina | Ser (S) | Ácido 2-amino-3-hidroxipropanoico | 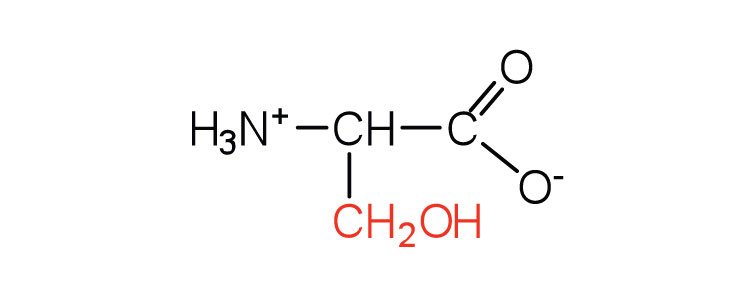 |
5.7 | encontrado en el sitio activo de muchas enzimas |
| treonina | Thr (T) | Ácido 2-amino-3-hidroxibutanoico | 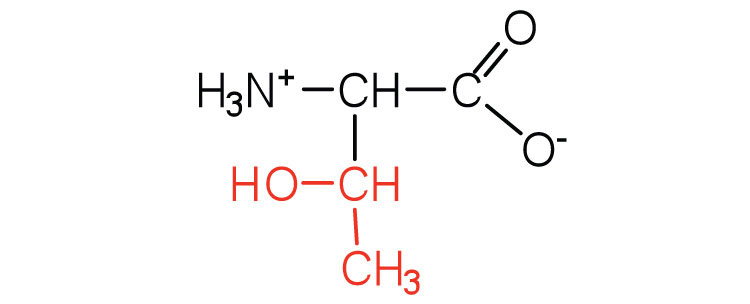 |
5.6 | llamado así por su similitud con la treosa de azúcar |
| cisteína | Cys (C) | Ácido 2-amino-3-mercaptopropanoico | 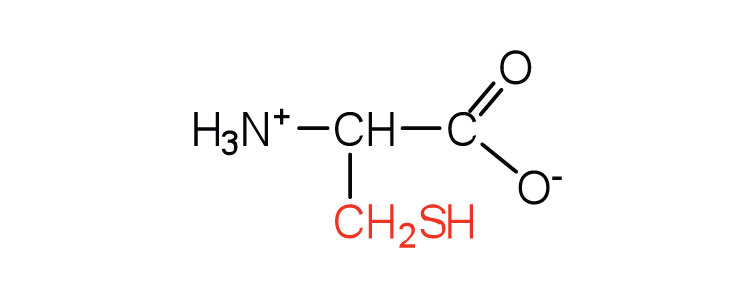 |
5.0 | la oxidación de dos moléculas de cisteína produce cistina |
| tirosina | Tyr (Y) | Ácido 2-amino-3- (4-hidroxifenil) -propanoico | 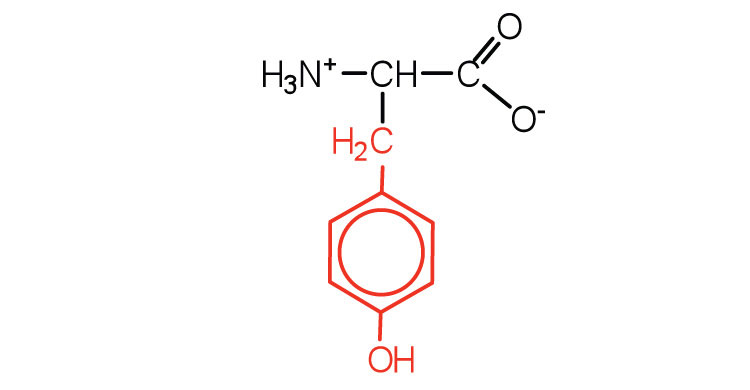 |
5.7 | también clasificado como un aminoácido aromático |
| asparagina | Asn (N) | Ácido 2-amino-3-carbamoilpropanoico | 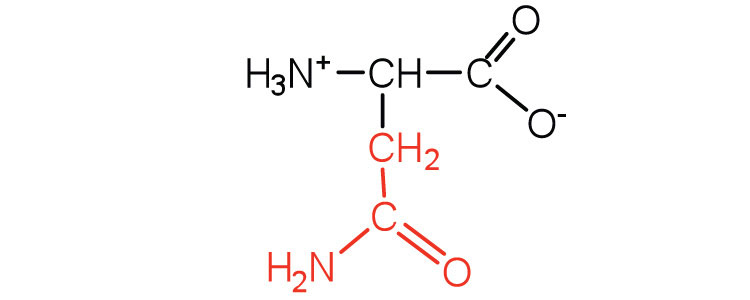 |
5.4 | la amida del ácido aspártico |
| glutamina | Gln (Q) | Ácido 2-amino-4-carbamoilbutanoico | 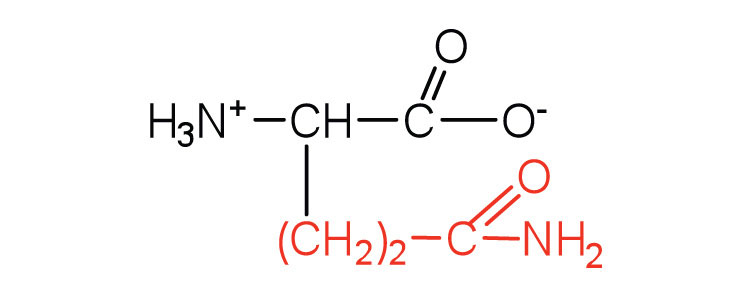 |
5.7 | la amida del ácido glutámico |
| Aminoácidos con un grupo R cargado negativamente | |||||
| ácido aspártico | Asp (D) | Ácido 2-aminobutanodioico | 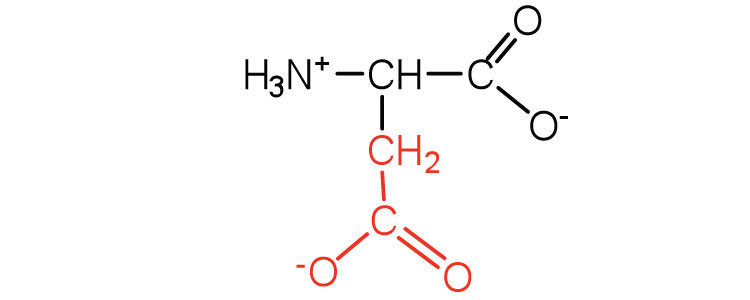 |
3.0 | los grupos carboxilo se ionizan a pH fisiológico; también conocido como aspartato |
| ácido glutámico | Glu (E) | Ácido 2-aminopentanodioico | 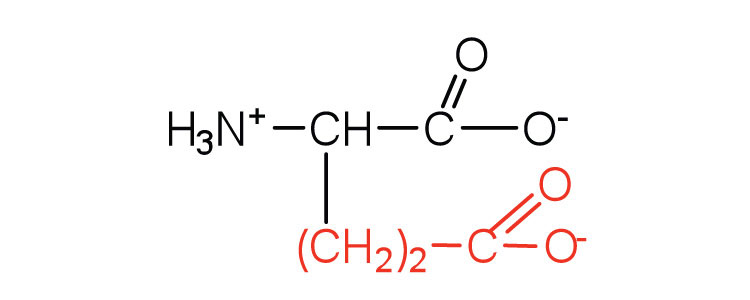 |
3.2 | los grupos carboxilo se ionizan a pH fisiológico; también conocido como glutamato |
| Aminoácidos con un grupo R cargado positivamente | |||||
| histidina | Su (H) | Ácido 2-amino-3- (1H-imidazol-4-il) -propanoico | 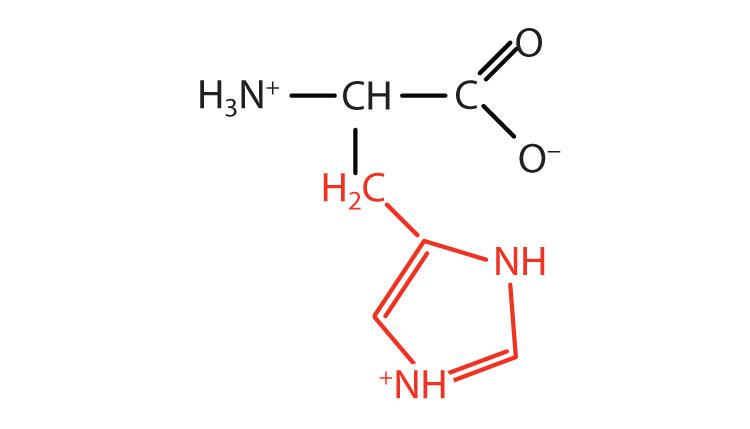 |
7.6 | el único aminoácido cuyo grupo R tiene un pH pK a (6.0) cercano a fisiológico |
| lisina | Lys (K) | ácido 2,6-diaminohexanoico | 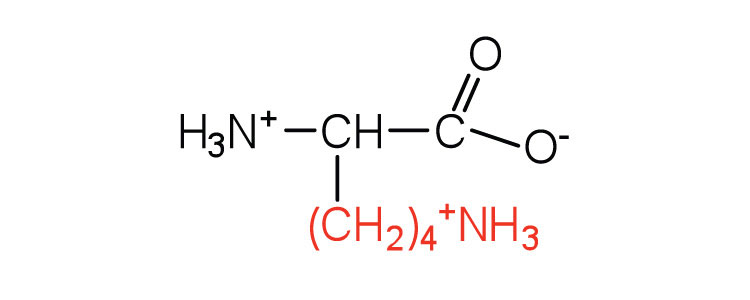 |
9.7 | es algo anfipático debido a la larga cola de hidrocarburo y al grupo amino cargado positivamente en el\(\epsilon\) carbono |
| arginina | Arg (R) | Ácido 2-amino-5-guanidinopentanoico | 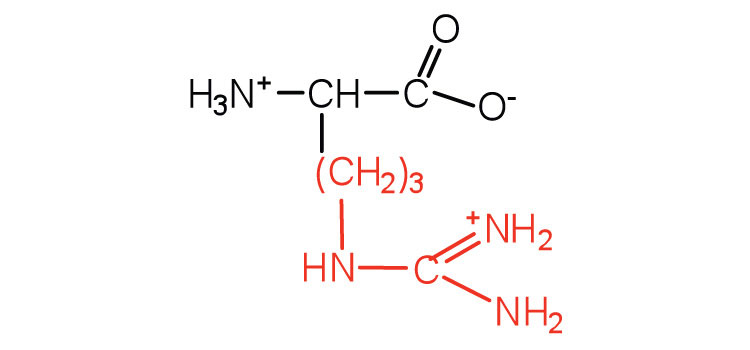 |
10.8 | una base casi tan fuerte como el hidróxido de sodio |
El primer aminoácido que se aisló fue la asparagina en 1806. Se obtuvo de la proteína que se encuentra en el jugo de espárragos (de ahí el nombre). La glicina, el principal aminoácido que se encuentra en la gelatina, fue nombrada por su sabor dulce (glykys griegos, que significa “dulce”). El ácido glutámico se llama como tal porque primero se aisló del gluten. La sal cristalina del ácido glutámico se llama glutamato monosódico (MSG), que se encuentra de forma natural en algunos alimentos pero también se agrega como un potenciador del sabor salado o “umami”.
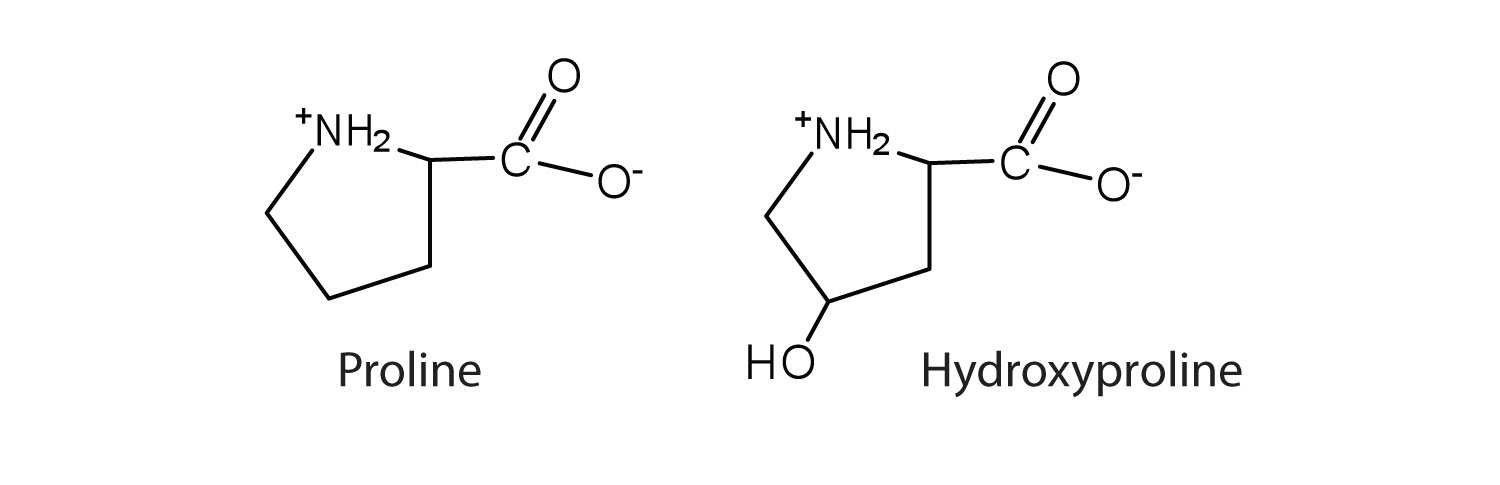
En algunos casos, un aminoácido que se encuentra en una proteína es en realidad un derivado de uno de los 20 aminoácidos comunes (uno de esos derivados es la hidroxiprolina). La modificación de la prolina ocurre después de que el aminoácido ha sido ensamblado en una proteína.
Quiralidad de Aminoácidos
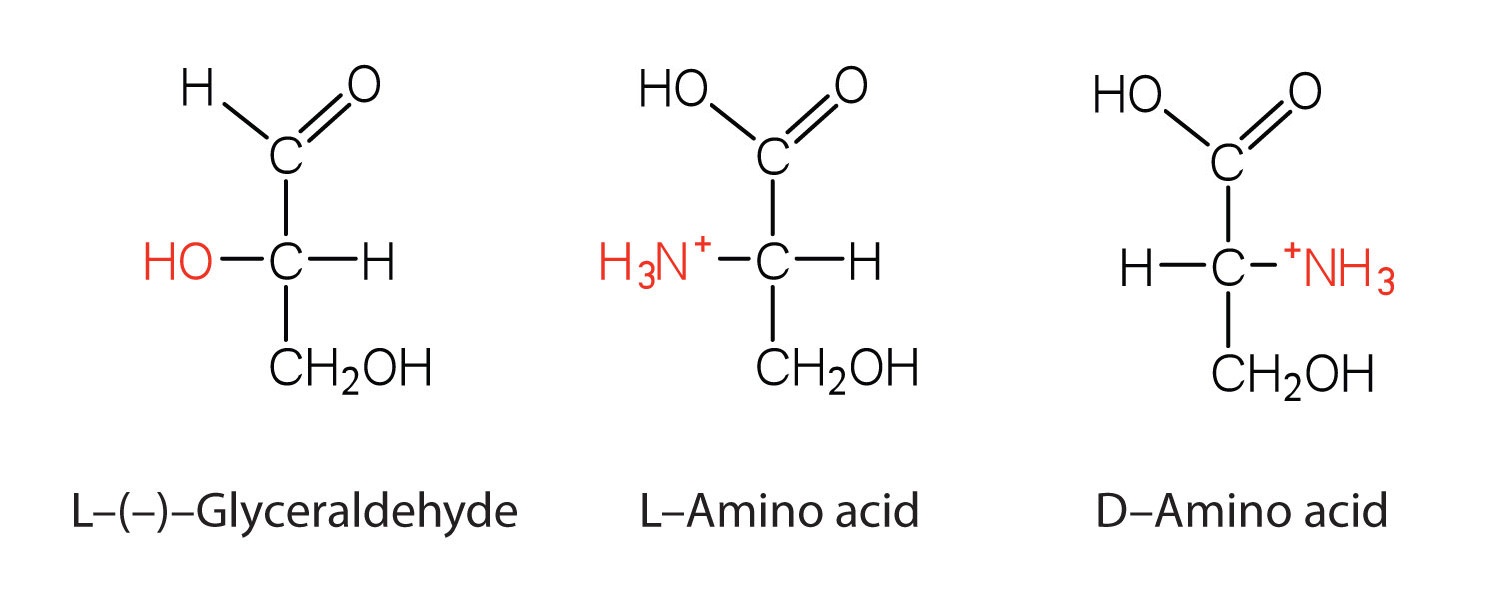
Observe en la Tabla\(\PageIndex{1}\) que la glicina es el único aminoácido cuyo (\ alfa\) -carbono no es quiral, es decir, la molécula y la imagen especular de la glicina son idénticas. Todos los demás aminoácidos tienen dos formas que son imágenes especulares entre sí, son enantiómeros. Como se puede ver en la siguiente figura, la forma “zurda” de la molécula se conoce como el L-aminoácido y la forma “diestra” es el D-aminoácido.
Resumen
Los aminoácidos se pueden clasificar en función de las características de sus cadenas laterales distintivas como no polares, polares pero no cargados, cargados negativamente o cargados positivamente. Los aminoácidos que se encuentran en las proteínas son L-aminoácidos.


