18.4: Propiedades ácido-Base de los Aminoácidos
- Page ID
- 73154
- Explicar cómo un aminoácido puede actuar tanto como ácido como base.
La estructura de un aminoácido le permite actuar tanto como ácido como base. Un aminoácido tiene esta capacidad porque a un cierto valor de pH (diferente para cada aminoácido) casi todas las moléculas de aminoácidos existen como zwitteriones. Si se agrega ácido a una solución que contiene el zwitterión, el grupo carboxilato captura un ion hidrógeno (H +), y el aminoácido se carga positivamente. Si se agrega base, la eliminación de iones del ion H + del grupo amino del zwitterión produce un aminoácido cargado negativamente. En ambas circunstancias, el aminoácido actúa para mantener el pH del sistema, es decir, para eliminar el ácido agregado (H +) o la base (OH −) de la solución.
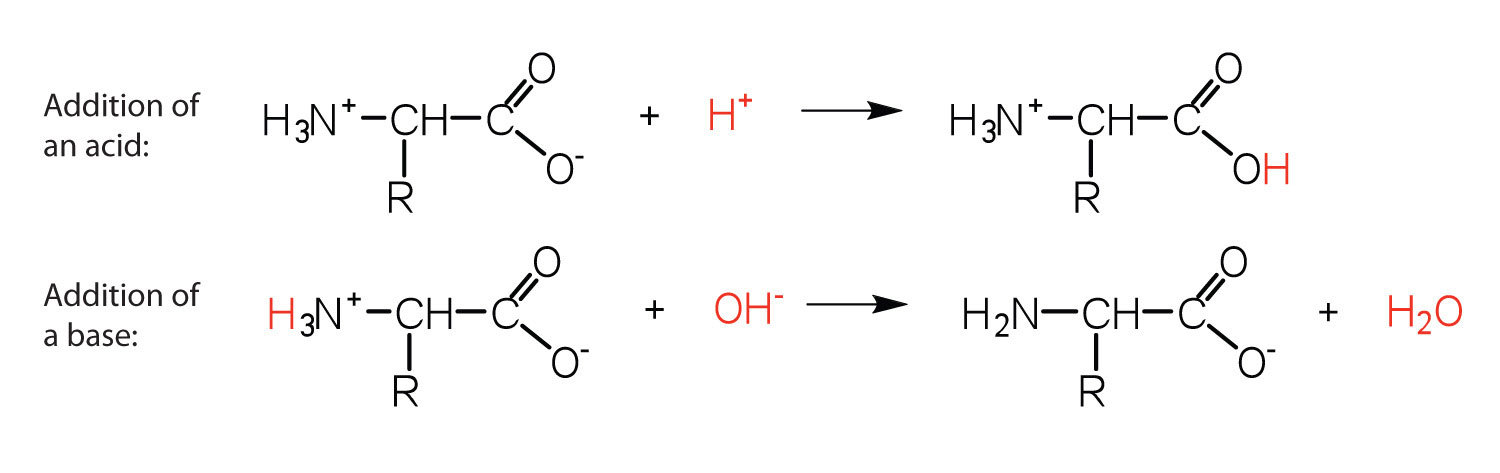
- Dibuja la estructura para el anión formado cuando la glicina (a pH neutro) reacciona con una base.
- Dibujar la estructura para el catión formado cuando la glicina (a pH neutro) reacciona con un ácido.
Solución
- La base elimina H + del grupo amina protonada.
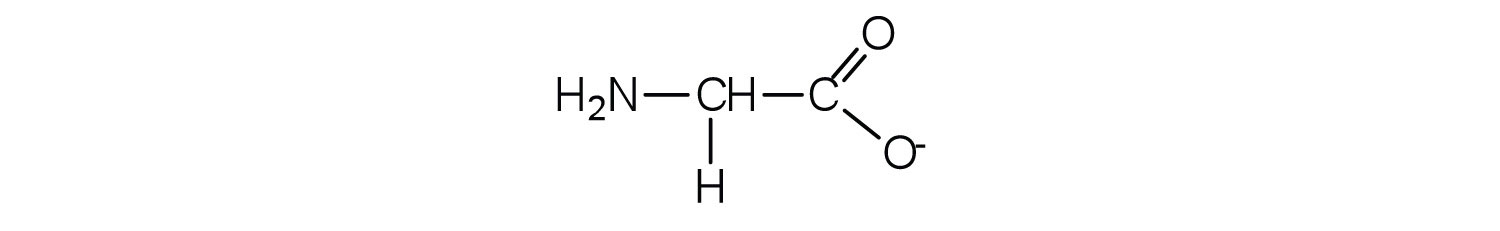
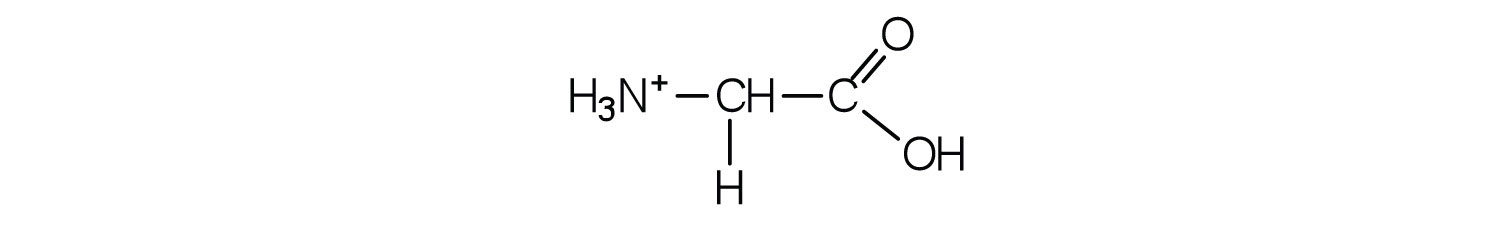
- Dibujar la estructura para el catión formado cuando la valina (a pH neutro) reacciona con un ácido.
- Dibuja la estructura para el anión formado cuando la valina (a pH neutro) reacciona con una base.
El pH particular al que existe un aminoácido dado en solución como un zwitterión se denomina punto isoeléctrico (pI). En su pI, las cargas positivas y negativas en el balance de aminoácidos, y la molécula en su conjunto es eléctricamente neutra. Los aminoácidos cuyas cadenas laterales son siempre neutras tienen puntos isoeléctricos que van de 5.0 a 6.5. Los aminoácidos básicos (que tienen cadenas laterales cargadas positivamente a pH neutro) tienen ejemplos relativamente altos. Los aminoácidos ácidos (que tienen cadenas laterales cargadas negativamente a pH neutro) tienen ejemplos bastante bajos (Tabla\(\PageIndex{1}\)).
| Aminoácido | Clasificación | pI |
|---|---|---|
| alanina | no polar | 6.0 |
| valina | no polar | 6.0 |
| serina | polar, sin carga | 5.7 |
| treonina | polar, sin carga | 6.5 |
| arginina | cargado positivamente (básico) | 10.8 |
| histidina | cargado positivamente (básico) | 7.6 |
| lisina | cargado positivamente (básico) | 9.8 |
| ácido aspártico | cargado negativamente (ácido) | 3.0 |
| ácido glutámico | cargado negativamente (ácido) | 3.2 |
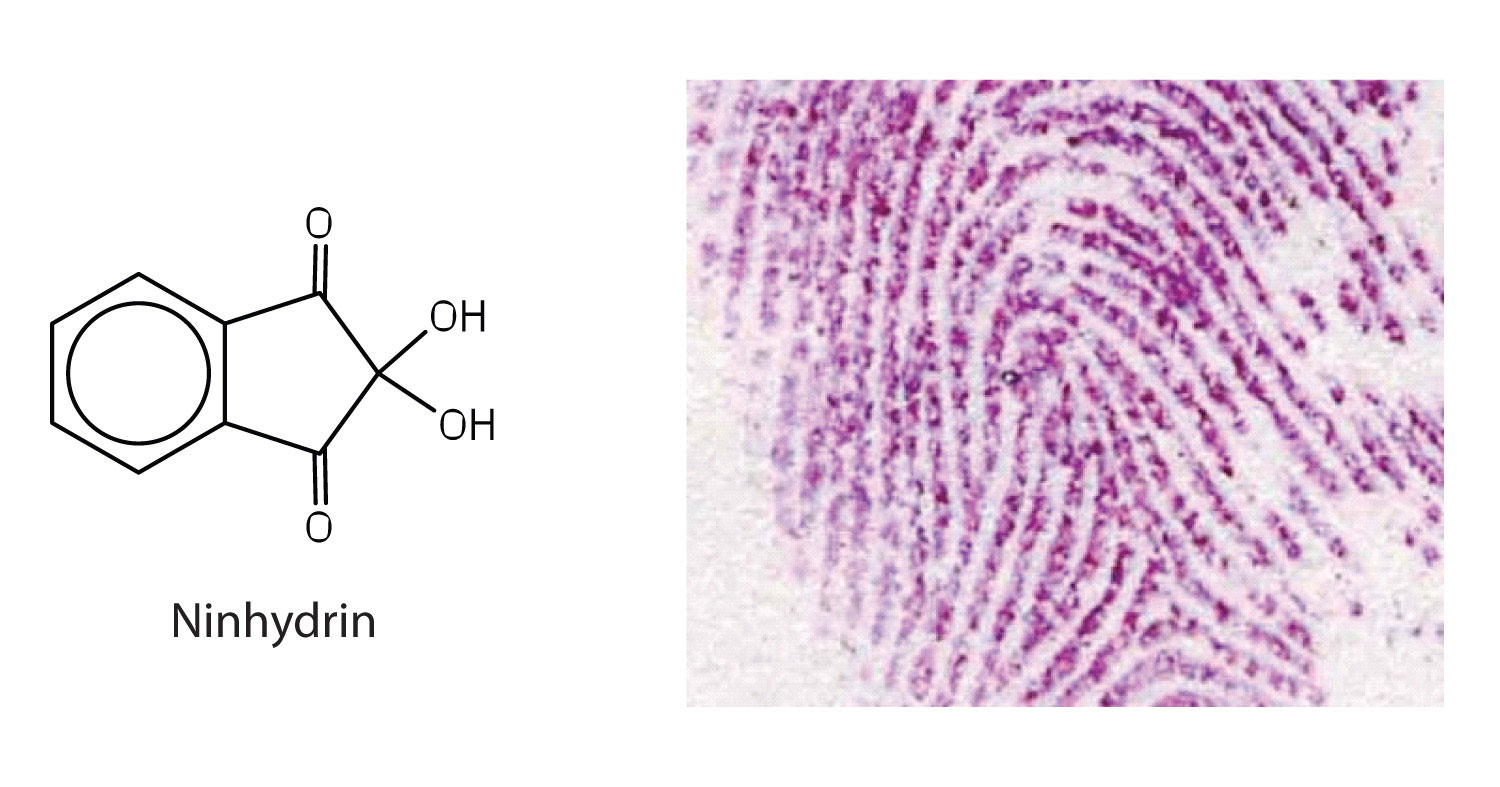
Los aminoácidos experimentan reacciones características de ácidos carboxílicos y aminas. La reactividad de estos grupos funcionales es particularmente importante para unir aminoácidos entre sí para formar péptidos y proteínas, como verá más adelante en este capítulo. Las pruebas químicas simples que se utilizan para detectar aminoácidos aprovechan la reactividad de estos grupos funcionales. Un ejemplo es la prueba de ninhidrina en la que el grupo funcional amina de los α-aminoácidos reacciona con la ninhidrina para formar compuestos de color púrpura. La ninhidrina se utiliza para detectar huellas dactilares porque reacciona con los aminoácidos de las proteínas en las células de la piel transferidas a la superficie por el individuo dejando la huella dactilar.
Resumen
Los aminoácidos pueden actuar tanto como ácido como base debido a la presencia de los grupos funcionales amino y carboxilo. El pH al que existe un aminoácido dado en solución como zwitterión se denomina punto isoeléctrico (pI).

