18.10: Propiedades Químicas de las Proteínas
- Page ID
- 73120
- Objetivo 1
- Objetivo 2
Hidrólisis de proteínas
Desnaturalización de proteínas
Las estructuras altamente organizadas de las proteínas son verdaderas obras maestras de la arquitectura química. Pero las estructuras altamente organizadas tienden a tener cierta delicadeza, y esto es cierto en el caso de las proteínas. La desnaturalización es el término utilizado para cualquier cambio en la estructura tridimensional de una proteína que la hace incapaz de realizar su función asignada. Una proteína desnaturalizada no puede hacer su trabajo. (A veces la desnaturalización se equipara con la precipitación o coagulación de una proteína; nuestra definición es un poco más amplia). Una amplia variedad de reactivos y condiciones, como calor, compuestos orgánicos, cambios de pH e iones de metales pesados pueden causar desnaturalización de proteínas (Figura\(\PageIndex{1}\)).
| Método | Efecto sobre la estructura proteica |
|---|---|
| Calor por encima de 50°C o radiación ultravioleta (UV) | El calor o la radiación UV suministra energía cinética a las moléculas proteicas, haciendo que sus átomos vibren más rápidamente y alterando las fuerzas de enlace de hidrógeno y dispersión relativamente débiles. |
| Uso de compuestos orgánicos, como el alcohol etílico | Estos compuestos son capaces de participar en enlaces de hidrógeno intermoleculares con moléculas de proteína, interrumpiendo los enlaces de hidrógeno intramoleculares dentro de la proteína. |
| Sales de iones de metales pesados, como mercurio, plata y plomo | Estos iones forman enlaces fuertes con los aniones carboxilato de los aminoácidos ácidos o grupos SH de la cisteína, alterando los enlaces iónicos y los enlaces disulfuro. |
| Reactivos alcaloides, como el ácido tánico (utilizado en el curtido de cuero) | Estos reactivos se combinan con grupos amino cargados positivamente en proteínas para interrumpir los enlaces iónicos. |
Cualquiera que haya frito un huevo ha observado desnaturalización. La clara de huevo clara se vuelve opaca a medida que la albúmina se desnaturaliza y coagula. Nadie ha revertido todavía ese proceso. Sin embargo, dadas las circunstancias adecuadas y el tiempo suficiente, una proteína que se ha desplegado en condiciones suficientemente suaves puede replegarse y volver a exhibir actividad biológica (Figura\(\PageIndex{8}\)). Dicha evidencia sugiere que, al menos para estas proteínas, la estructura primaria determina la estructura secundaria y terciaria. Una secuencia dada de aminoácidos parece adoptar su disposición tridimensional particular de forma natural si las condiciones son adecuadas.
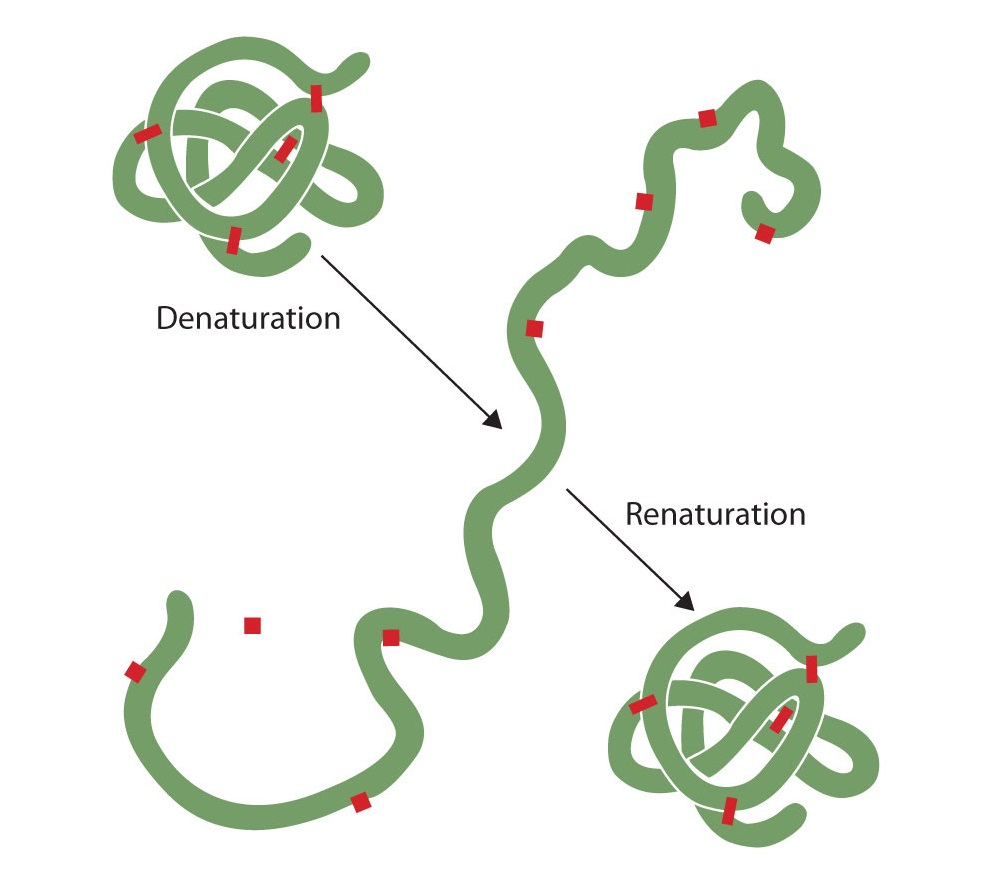
Las estructuras primarias de las proteínas son bastante robustas. En general, se necesitan condiciones bastante vigorosas para hidrolizar los enlaces peptídicos. En los niveles secundario a cuaternario, sin embargo, las proteínas son bastante vulnerables al ataque, aunque varían en su vulnerabilidad a la desnaturalización. Las proteínas globulares delicadamente plegadas son mucho más fáciles de desnaturalizar que las proteínas duras y fibrosas del cabello y la piel.

