19.4: Cómo funcionan las enzimas
- Page ID
- 73525
- Describir la interacción entre una enzima y su sustrato.
Las reacciones catalizadas por enzimas ocurren en al menos dos etapas. En el primer paso, una enzima (E) y la molécula sustrato o moléculas (S) colisionan y reaccionan para formar un compuesto intermedio llamado complejo enzima-sustrato (ES). (Este paso es reversible porque el complejo puede romperse en el sustrato o sustratos originales y la enzima libre). Una vez que se forma el complejo ES, la enzima es capaz de catalizar la formación del producto (P), que luego se libera de la superficie de la enzima:
\[E + S \leftrightarrow ES \tag{\(\PageIndex{1}\)} \]
\[ES \rightarrow E + P \tag{\(\PageIndex{2}\)} \]
Los enlaces de hidrógeno y otras interacciones electrostáticas mantienen la enzima y el sustrato juntos en el complejo. Las características estructurales o grupos funcionales en la enzima que participan en estas interacciones se localizan en una hendidura o bolsillo en la superficie de la enzima. Este bolsillo, donde la enzima se combina con el sustrato y transforma el sustrato en producto se denomina el sitio activo de la enzima (Figura\(\PageIndex{1}\)).
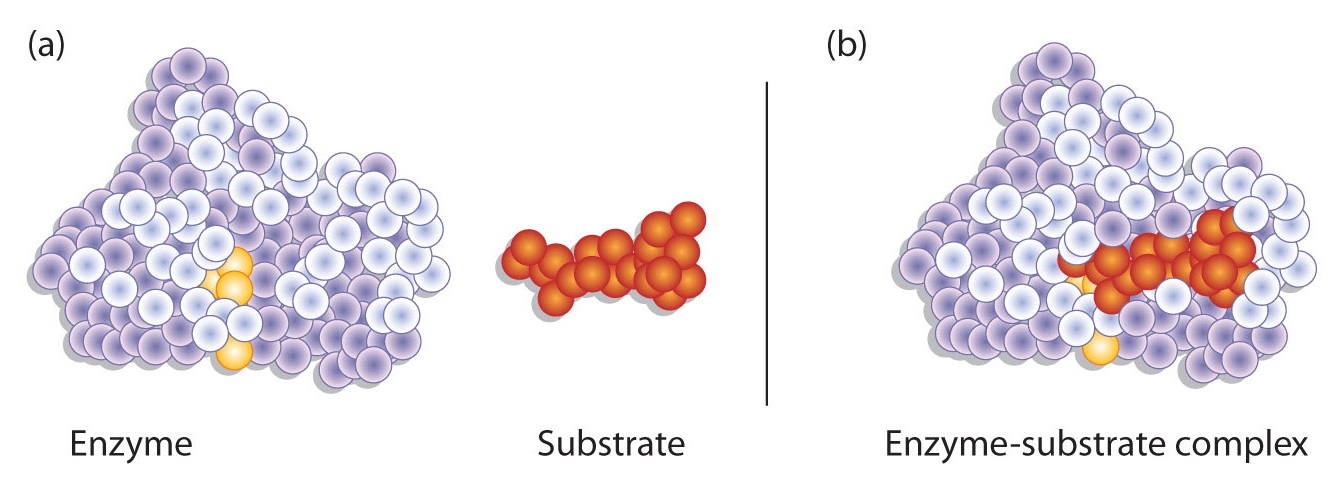
Modelos de Interacción Enzima-Sustrato
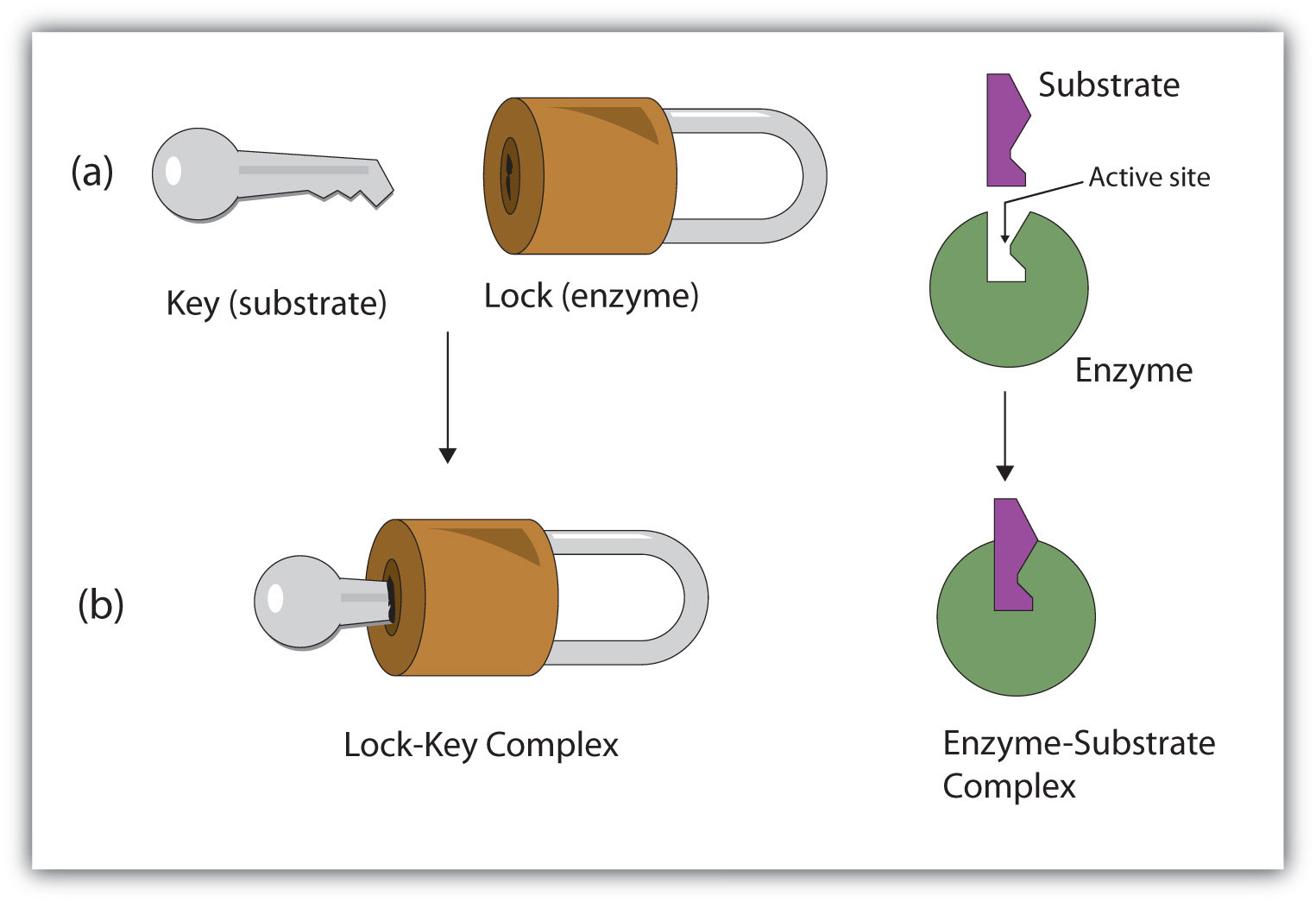
El sitio activo de una enzima posee una conformación única (incluyendo grupos de unión correctamente posicionados) que es complementaria a la estructura del sustrato, de manera que las moléculas de enzima y sustrato encajan entre sí de la misma manera que una llave encaja en una cerradura de vaso. De hecho, un modelo temprano que describe la formación del complejo enzima-sustrato se llamó el modelo de cerradura y llave (Figura\(\PageIndex{2}\)). Este modelo retrató a la enzima como conformacionalmente rígida y capaz de unirse solo a sustratos que se ajustan exactamente al sitio activo.
La elaboración de las estructuras tridimensionales precisas de numerosas enzimas ha permitido a los químicos refinar el modelo original de bloqueo y llave de acciones enzimáticas. Descubrieron que la unión de un sustrato a menudo conduce a un gran cambio conformacional en la enzima, así como a cambios en la estructura del sustrato o sustratos. La teoría actual, conocida como el modelo de ajuste inducido, dice que las enzimas pueden sufrir un cambio en la conformación cuando se unen a moléculas de sustrato, y el sitio activo tiene una forma complementaria a la del sustrato solo después de que se une el sustrato, como se muestra para la hexoquinasa en la Figura \(\PageIndex{3}\). Después de la catálisis, la enzima retoma su estructura original.
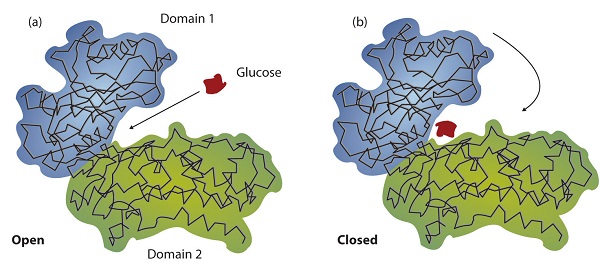
Los cambios estructurales que ocurren cuando una enzima y un sustrato se unen acercan partes específicas de un sustrato en alineación con partes específicas del sitio activo de la enzima. Las cadenas laterales de aminoácidos en o cerca del sitio de unión pueden actuar entonces como catalizadores ácidos o básicos, proporcionar sitios de unión para la transferencia de grupos funcionales de un sustrato a otro o ayudar en el reordenamiento de un sustrato. Los aminoácidos participantes, que suelen estar ampliamente separados en la secuencia primaria de la proteína, se acercan en el sitio activo como resultado del plegamiento y flexión de la cadena o cadenas polipeptídicas cuando la proteína adquiere su estructura terciaria y cuaternaria. La unión a las enzimas acerca los reactivos entre sí y los alinea adecuadamente, lo que tiene el mismo efecto que aumentar la concentración de los compuestos reaccionantes.
- ¿Qué tipo de interacción ocurriría entre un grupo OH presente en una molécula sustrato y un grupo funcional en el sitio activo de una enzima?
- Sugiera un aminoácido cuya cadena lateral podría estar en el sitio activo de una enzima y formar el tipo de interacción que acabas de identificar.
Solución
- Un grupo OH probablemente se involucraría en enlaces de hidrógeno con un grupo funcional apropiado presente en el sitio activo de una enzima.
- Varias cadenas laterales de aminoácidos podrían engancharse en enlaces de hidrógeno con un grupo OH. Un ejemplo sería la asparagina, que tiene un grupo funcional amida.
- ¿Qué tipo de interacción ocurriría entre un grupo COO − presente en una molécula sustrato y un grupo funcional en el sitio activo de una enzima?
- Sugiera un aminoácido cuya cadena lateral podría estar en el sitio activo de una enzima y formar el tipo de interacción que acabas de identificar.
Una característica que distingue a una enzima de todos los demás tipos de catalizadores es su especificidad de sustrato. Un ácido inorgánico como el ácido sulfúrico puede usarse para aumentar las velocidades de reacción de muchas reacciones diferentes, como la hidrólisis de disacáridos, polisacáridos, lípidos y proteínas, con total imparcialidad. En contraste, las enzimas son mucho más específicas. Algunas enzimas actúan sobre un solo sustrato, mientras que otras enzimas actúan sobre cualquiera de un grupo de moléculas relacionadas que contienen un grupo funcional o enlace químico similar. Algunas enzimas incluso distinguen entre los estereoisómeros D y L, uniéndose a un estereoisómero pero no al otro. La ureasa, por ejemplo, es una enzima que cataliza la hidrólisis de un solo sustrato, la urea, pero no los compuestos estrechamente relacionados metil urea, tiourea o biuret. La enzima carboxipeptidasa, por otro lado, es mucho menos específica. Cataliza la eliminación de casi cualquier aminoácido del extremo carboxilo de cualquier péptido o proteína.
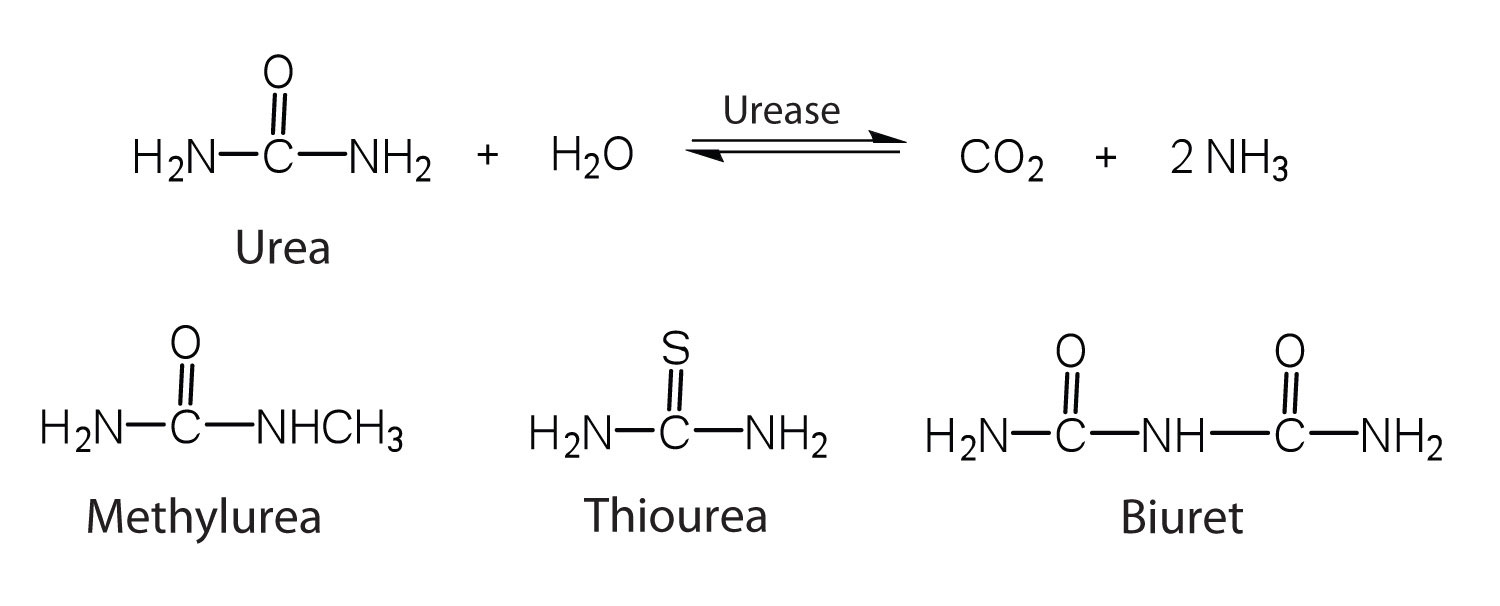
La especificidad enzimática es el resultado de la singularidad del sitio activo en cada enzima diferente debido a la identidad, carga y orientación espacial de los grupos funcionales ubicados allí. Regula la química celular para que las reacciones adecuadas ocurran en el lugar adecuado y en el momento adecuado. Claramente, es crucial para el buen funcionamiento de la célula viva.
Resumen
Un sustrato se une a una región específica en una enzima conocida como el sitio activo, donde el sustrato se puede convertir en producto. El sustrato se une a la enzima principalmente a través de enlaces de hidrógeno y otras interacciones electrostáticas. El modelo de ajuste inducido dice que una enzima puede sufrir un cambio conformacional al unirse a un sustrato. Las enzimas presentan diversos grados de especificidad de sustrato.

