19.5: Factores que afectan la actividad enzimática
- Page ID
- 73539
- Describir cómo el pH, la temperatura y la concentración de una enzima y su sustrato influyen en la actividad enzimática.
La propiedad más importante de las enzimas es la capacidad de aumentar las tasas de reacciones que ocurren en los organismos vivos, una propiedad conocida como actividad catalítica. Debido a que la mayoría de las enzimas son proteínas, su actividad se ve afectada por factores que alteran la estructura de las proteínas, así como por factores que afectan a los catalizadores en general. Los factores que alteran la estructura proteica incluyen la temperatura y el pH; los factores que afectan a los catalizadores en general incluyen la concentración de reactivo o sustrato y la concentración de catalizador o enzima La actividad de una enzima puede medirse monitoreando la velocidad a la que desaparece un sustrato o la velocidad a la que se forma un producto.
Concentración de sustrato
En presencia de una cantidad dada de enzima, la velocidad de una reacción enzimática aumenta a medida que aumenta la concentración de sustrato hasta que se alcanza una velocidad limitante, después de lo cual un aumento adicional en la concentración de sustrato no produce ningún cambio significativo en la velocidad de reacción (parte (a) de la Figura\(\PageIndex{1}\)). En este punto, tanto sustrato está presente que esencialmente todos los sitios activos enzimáticos tienen sustrato unido a ellos. Es decir, las moléculas enzimáticas están saturadas con sustrato. El exceso de moléculas de sustrato no puede reaccionar hasta que el sustrato ya unido a las enzimas haya reaccionado y haya sido liberado (o haya sido liberado sin reaccionar).
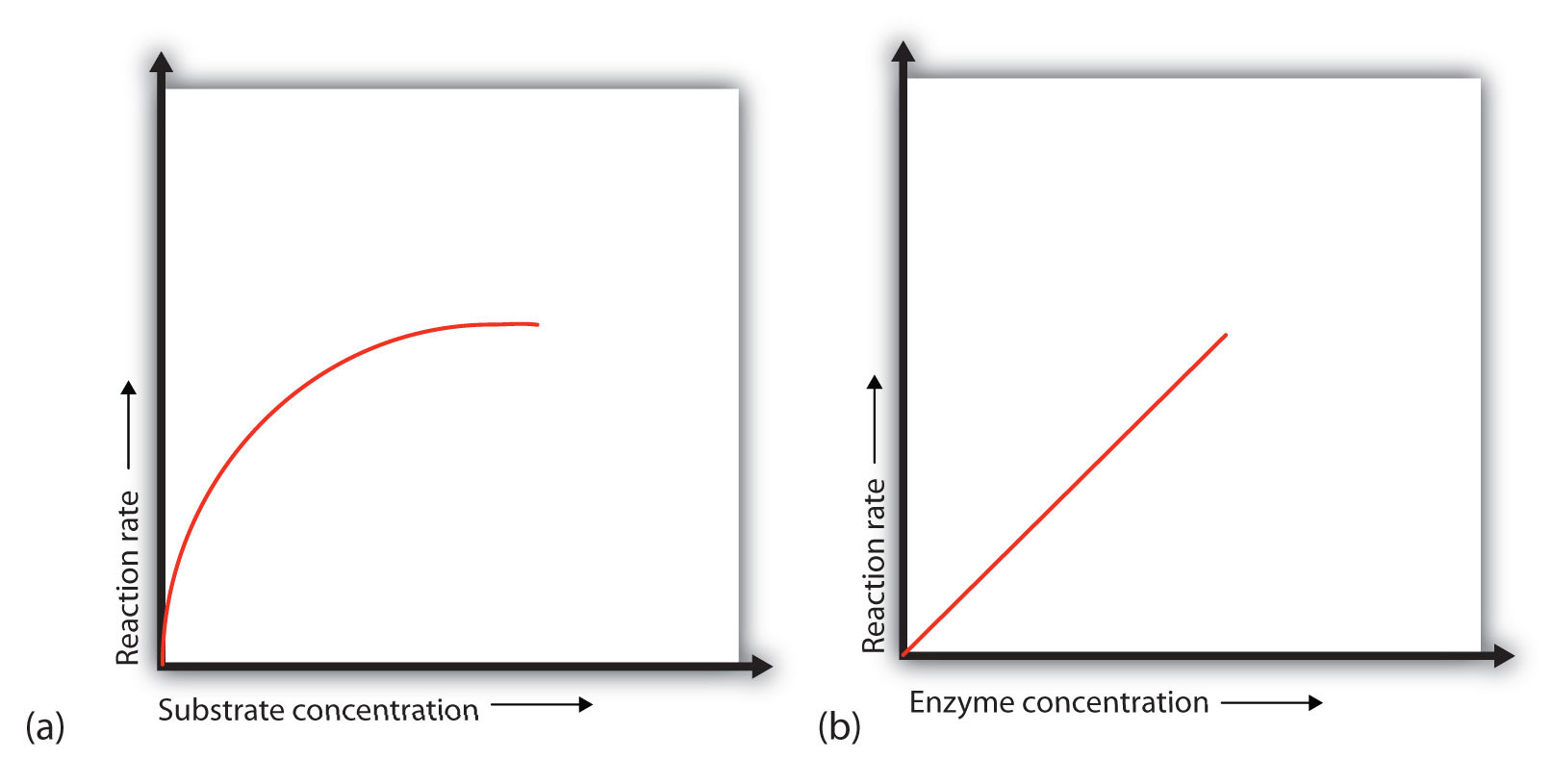
Consideremos una analogía. Diez taxis (moléculas enzimáticas) están esperando en una parada de taxis para llevar a las personas (sustrato) en un viaje de 10 minutos a una sala de conciertos, un pasajero a la vez. Si solo 5 personas están presentes en el stand, la tasa de su llegada a la sala de conciertos es de 5 personas en 10 minutos. Si el número de personas en el stand se incrementa a 10, la tasa aumenta a 10 llegadas en 10 minutos. Con 20 personas en el stand, la tarifa seguiría siendo de 10 llegadas en 10 minutos. Los taxis han estado “saturados”. Si los taxis pudieran llevar 2 o 3 pasajeros cada uno, se aplicaría el mismo principio. La tasa simplemente sería más alta (20 o 30 personas en 10 minutos) antes de que se nivelara.
Concentración de enzimas
Cuando la concentración de la enzima es significativamente menor que la concentración del sustrato (como cuando el número de taxis es mucho menor que el número de pasajeros en espera), la velocidad de una reacción catalizada por enzimas depende directamente de la concentración enzimática (parte (b) de la Figura\(\PageIndex{1}\)). Esto es cierto para cualquier catalizador; la velocidad de reacción aumenta a medida que aumenta la concentración del catalizador.
Efecto de la temperatura sobre la actividad
Una regla general para la mayoría de las reacciones químicas es que un aumento de temperatura de 10°C aproximadamente duplica la velocidad de reacción. Hasta cierto punto, esta regla se mantiene para todas las reacciones enzimáticas. Después de cierto punto, sin embargo, un aumento de la temperatura provoca una disminución en la velocidad de reacción enzimática, debido a la desnaturalización de la estructura de la proteína y la alteración del sitio activo (parte (a) de la Figura\(\PageIndex{2}\)). Para muchas proteínas, la desnaturalización ocurre entre 45°C y 55°C. Además, aunque una enzima puede parecer tener una velocidad de reacción máxima entre 40°C y 50°C, la mayoría de las reacciones bioquímicas se llevan a cabo a temperaturas más bajas debido a que las enzimas no son estables a estas temperaturas más altas y se desnaturalizarán después de una pocos minutos.
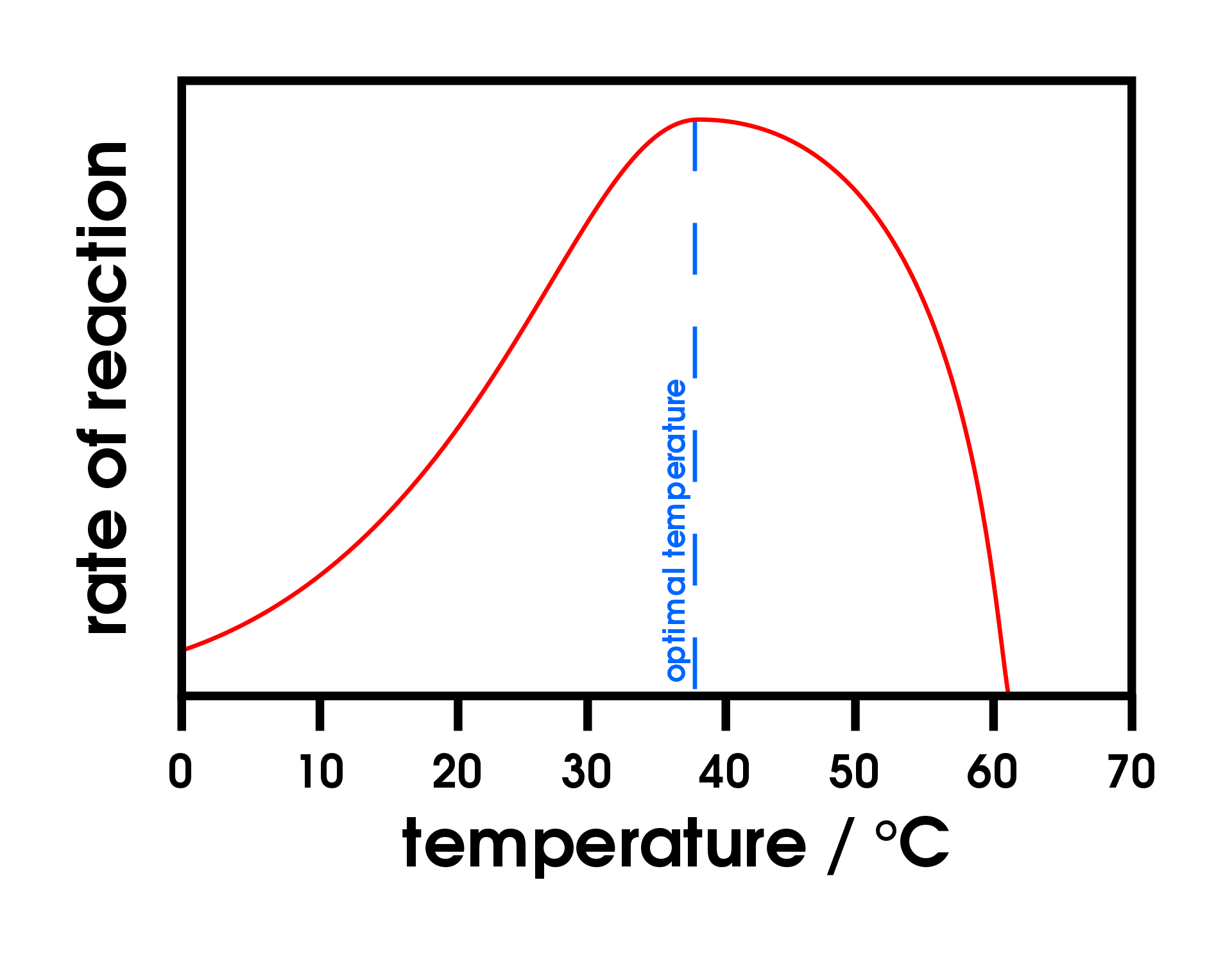
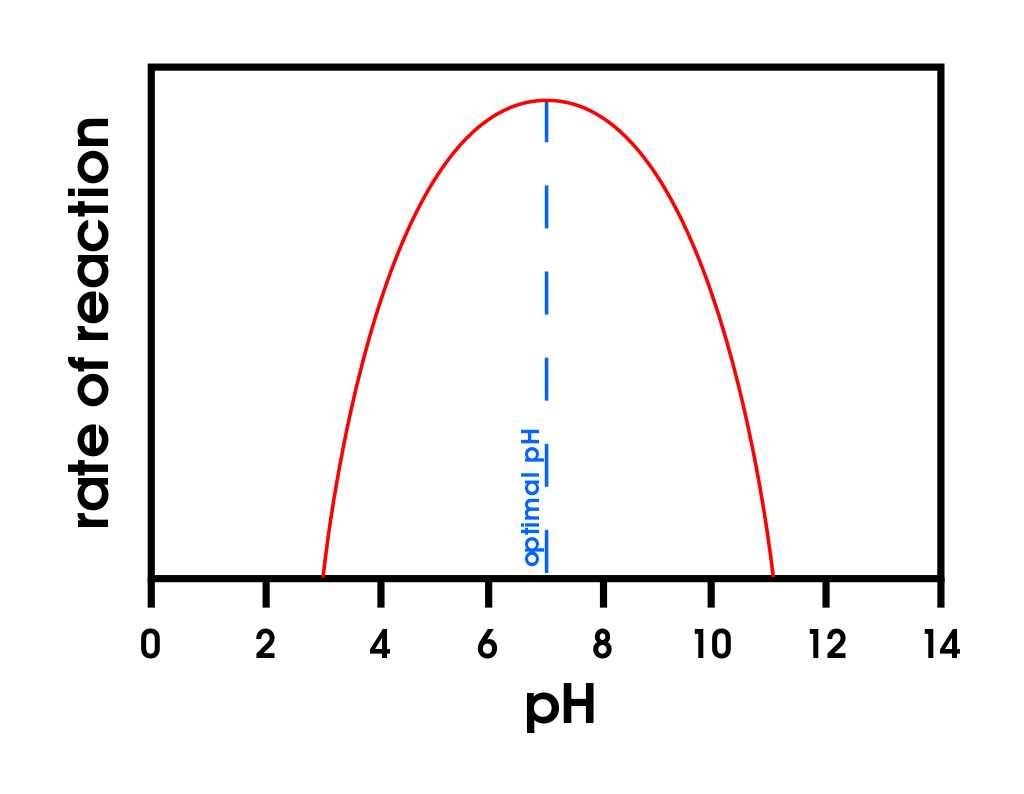
Figura\(\PageIndex{2}\): Temperatura y pH versus Concentración. (a) Esta gráfica representa el efecto de la temperatura sobre la velocidad de una reacción que es catalizada por una cantidad fija de enzima. (b) Esta gráfica representa el efecto del pH sobre la velocidad de una reacción que es catalizada por una cantidad fija de enzima.
A 0°C y 100°C, la velocidad de las reacciones catalizadas por enzimas es casi cero. Este hecho tiene varias aplicaciones prácticas. Esterilizamos objetos colocándolos en agua hirviendo, lo que desnaturaliza las enzimas de cualquier bacteria que pueda estar dentro o sobre ellos. Conservamos nuestros alimentos refrigerándolos o congelándolos, lo que ralentiza la actividad enzimática. Cuando los animales entran en hibernación en invierno, su temperatura corporal baja, disminuyendo las tasas de sus procesos metabólicos a niveles que pueden mantenerse por la cantidad de energía almacenada en las reservas de grasa en los tejidos de los animales.
Efecto de la concentración de iones hidrógeno (pH) sobre la actividad
Debido a que la mayoría de las enzimas son proteínas, son sensibles a los cambios en la concentración de iones hidrógeno o pH. Las enzimas pueden desnaturalizarse por niveles extremos de iones de hidrógeno (ya sean altos o bajos); cualquier cambio en el pH, incluso uno pequeño, altera el grado de ionización de los grupos laterales ácidos y básicos de una enzima y también los componentes del sustrato. Los grupos laterales ionizables localizados en el sitio activo deben tener cierta carga para que la enzima se una a su sustrato. La neutralización de incluso una de estas cargas altera la actividad catalítica de una enzima.
Una enzima exhibe una actividad máxima en el estrecho intervalo de pH en el que existe una molécula en su forma apropiadamente cargada. El valor medio de este rango de pH se denomina pH óptimo de la enzima (parte (b) de la Figura\(\PageIndex{2}\)). Con la notable excepción del jugo gástrico (los fluidos secretados en el estómago), la mayoría de los fluidos corporales tienen valores de pH entre 6 y 8. No es sorprendente que la mayoría de las enzimas exhiban actividad óptima en este intervalo de pH. Sin embargo, algunas enzimas tienen valores óptimos de pH fuera de este rango. Por ejemplo, el pH óptimo para la pepsina, una enzima que es activa en el estómago, es 2.0.
Resumen
Inicialmente, un aumento en la concentración de sustrato conduce a un aumento en la velocidad de una reacción catalizada por enzimas. A medida que las moléculas enzimáticas se saturan con sustrato, este aumento en la velocidad de reacción se desacelera La velocidad de una reacción catalizada por enzimas aumenta con un aumento en la concentración de una enzima. A bajas temperaturas, un aumento en la temperatura aumenta la velocidad de una reacción catalizada por enzimas. A temperaturas más altas, la proteína se desnaturaliza y la velocidad de reacción disminuye drásticamente. Una enzima tiene un rango óptimo de pH en el que exhibe máxima actividad.
Ejercicios de Revisión de Conceptos
- La concentración de sustrato X es baja. ¿Qué sucede con la velocidad de la reacción catalizada por enzimas si se duplica la concentración de X?
- ¿Qué efecto tiene un aumento en la concentración de enzimas sobre la velocidad de una reacción catalizada por enzimas?
RESPUESTAS
- Si la concentración del sustrato es baja, al aumentar su concentración se incrementará la velocidad de la reacción.
- Un aumento en la cantidad de enzima aumentará la velocidad de la reacción (siempre que esté presente suficiente sustrato).
Ejercicios
-
En reacciones no catalizadas por enzimas, la velocidad de reacción aumenta a medida que aumenta la concentración de reactivo. En una reacción catalizada por enzimas, la velocidad de reacción aumenta inicialmente a medida que aumenta la concentración de sustrato pero luego comienza a nivelarse, de manera que el aumento en la velocidad de reacción se vuelve cada vez menor a medida que aumenta la concentración de sustrato. Explique esta diferencia.
-
¿Por qué las enzimas se vuelven inactivas a temperaturas muy altas?
-
Una enzima tiene un pH óptimo de 7.4. ¿Qué es lo más probable que suceda con la actividad de la enzima si el pH desciende a 6.3? Explique.
-
Una enzima tiene un pH óptimo de 7.2. ¿Qué es lo más probable que suceda con la actividad de la enzima si el pH aumenta a 8.5? Explique.
RESPUESTAS
-
En una reacción catalizada por enzimas, el sustrato se une a la enzima para formar un complejo enzima-sustrato. Si hay más sustrato presente que enzima, todos los sitios de unión a la enzima tendrán sustrato unido, y los aumentos adicionales en la concentración de sustrato no pueden aumentar la velocidad.
-
La actividad disminuirá; un pH de 6.3 es más ácido que 7.4, y uno o más grupos clave en el sitio activo pueden unirse a un ion hidrógeno, cambiando la carga en ese grupo.

