19.7: Regulación enzimática - Control alostérico e inhibición de retroalimentación
- Page ID
- 73531
- Objetivo 1
- Objetivo 2
En la sección anterior aprendiste sobre los diferentes tipos de inhibidores enzimáticos y cómo se pueden usar para ralentizar o detener la actividad enzimática uniéndose a una enzima o complejo enzima-sustrato. Todos estos tipos de inhibidores, excepto los inhibidores no competitivos, funcionan uniéndose a sitios activos enzimáticos. Los inhibidores no competitivos, sin embargo, funcionan uniéndose a una enzima en una ubicación distinta del sitio activo, un sitio alostérico. Los inhibidores y otras moléculas, llamadas activadores, que se unen a enzimas en sitios alostéricos se consideran una parte importante de la regulación enzimática llamada control alostérico. En esta sección, analizaremos el control alostérico y el control de retroalimentación, dos formas en las que la actividad enzimática se regula de manera diferente.
Control alostérico
Las enzimas alostéricas tienen tanto un sitio de unión, para la unión al sustrato y catálisis, como un sitio alostérico, para la regulación de la actividad enzimática. Cuando una molécula reguladora se une al sitio alostérico de una enzima, generalmente por interacciones no covalentes, se produce un cambio conformacional en el sitio activo de la enzima, lo que afecta la unión al sustrato y las velocidades de reacción. La regulación alostérica de la actividad enzimática puede ser positiva, aumentando las velocidades de reacción o negativas, disminuyendo las velocidades de reacción.
Cuando una enzima se une a un regulador negativo (o inhibidor), sufrirá un cambio en el sitio activo de una manera que impide la unión del sustrato, disminuyendo así la velocidad de reacción. Como se ilustra en el panel izquierdo de la Figura\(\PageIndex{1}\), el sitio activo cambia (se vuelve más pequeño en este caso) y el sustrato ya no puede unirse. Los reguladores positivos (activadores) se unen a sitios alostéricos y provocan cambios conformacionales que abren un sitio activo para promover la unión al sustrato, permitiendo la catálisis o aumentando la velocidad de reacción. El panel derecho de la Figura\(\PageIndex{1}\) muestra una enzima que solo se unirá al sustrato cuando se forme el sitio activo después de que se una el activador alostérico.
Algunas enzimas tendrán más de un sitio alostérico que puede interactuar entre sí, lo que permite velocidades de reacción altamente controladas o ajustadas con precisión.

Control de retroalimentación
Muchos procesos biológicos implican la acción secuencial de múltiples enzimas, una vía de reacción, en la que el producto de una reacción es el sustrato para la siguiente enzima y así sucesivamente hasta que se forma el producto final. La regulación positiva o negativa de estas vías a menudo ocurre mediante el control de retroalimentación, donde un producto desde uno de los pasos en el camino retrocede hasta un paso anterior en el proceso para aumentar o disminuir la producción. Puede ayudar a visualizar una línea de ensamblaje de fábrica con cada persona responsable de un paso (reacción catalítica) en la fabricación de una caja perfecta de 12 donas. Si la última persona en la fila, que se encarga de poner 12 donas en la caja, se queda atrás, las donas comenzarán a acumularse. Para no desperdiciar donas o tener menos de cajas llenas al final, sería beneficioso señalar a las demás personas que disminuyan la velocidad o tomen un descanso. El proceso es similar en las vías bioquímicas: si se está formando demasiado producto, es necesario apagar la vía para que no se desperdicien energía y recursos.
Considere la ruta que se muestra a continuación en la que el sustrato A se convierte en el producto D a través de tres enzimas y dos productos intermedios (B y C):
\(A\ \xrightarrow{Enzyme\ 1}\ B\ \xrightarrow{Enzyme\ 2}\ C\ \xrightarrow{Enzyme\ 3}\ D\)
Si hay mucho producto D formado, habría suficiente para unirse a la Enzima 1, que inhibiría la formación de los productos B, y posteriormente el producto C, y D. Este tipo de control de retroalimentación es útil para evitar el desperdicio del sustrato A y cualquier energía que se necesite para la actividad de las Enzimas 1-3. Como verá en capítulos posteriores, hay muchos tipos diferentes de control de retroalimentación que pueden regular tanto negativa como positivamente las vías. Típicamente, el control de retroalimentación ocurre en puntos en vías donde sería energéticamente desfavorable proceder si no se necesita el producto final.
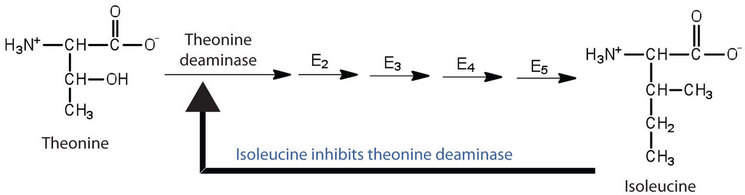
La inhibición de retroalimentación se utiliza para regular la síntesis de muchos aminoácidos. Por ejemplo, las bacterias sintetizan isoleucina a partir de treonina en una serie de cinco etapas catalizadas por enzimas. A medida que aumenta la concentración de isoleucina, parte de ella se une como inhibidor no competitivo a la primera enzima de la serie (treonina desaminasa), provocando así una disminución en la cantidad de isoleucina que se forma (Figura\(\PageIndex{2}\)).