19.6: Regulación Enzimática - Inhibición
- Page ID
- 73538
- Explique qué es un inhibidor enzimático.
- Distinga entre inhibidores reversibles e irreversibles.
- Distinguir entre inhibidores competitivos, no competitivos y no competitivos.
Anteriormente, notamos que las enzimas pueden ser inactivadas a altas temperaturas y por cambios en el pH. Se trata de factores inespecíficos que inactivarían cualquier enzima. La actividad de las enzimas también puede ser regulada por inhibidores más específicos que ralentizan o detienen la catálisis. La inhibición enzimática puede ser reversible o irreversible. En la inhibición reversible, el inhibidor puede unirse (generalmente no covalentemente) y disociarse, permitiendo que la actividad enzimática vuelva a su nivel original, desinhibido. Los inhibidores irreversibles se unen a la enzima de forma permanente y así inhiben permanentemente la actividad enzimática
Inhibición reversible
La inhibición enzimática reversible puede ser competitiva, no competitiva o no competitiva, dependiendo de dónde se una el inhibidor a la enzima, sustrato o complejo enzima-sustrato.
La inhibición competitiva es cuando un inhibidor se une reversiblemente a una enzima en el sitio activo de la enzima; compitiendo con el sustrato por la unión. Un inhibidor competitivo debe ser una molécula que sea estructuralmente similar a la molécula sustrato, permitiendo que interactúe con el sitio activo de la enzima a través de interacciones no covalentes similares, pero no sufra, o no pueda, la misma reacción química. Cuando el inhibidor se une al sitio activo, bloquea la unión del sustrato correcto y la catálisis se produce. Sin embargo, como inhibidor reversible, puede disociarse de la enzima eventualmente permitiendo que el sustrato correcto se una y que ocurra la catálisis. Debido a que el inhibidor y el sustrato compiten por el mismo sitio activo, la inhibición depende de la concentración. Como se muestra en la siguiente gráfica de velocidad de reacción frente a concentración de sustrato (Figura\(\PageIndex{1}\)), el inhibidor competitivo ralentiza la velocidad de reacción, pero a mayores concentraciones de sustrato, se puede alcanzar la velocidad máxima normal.
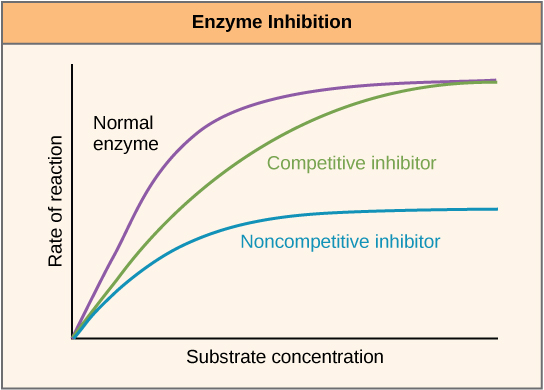
Figura\(\PageIndex{1}\): Gráficas de velocidad de reacción vs. concentración de sustrato con y sin inhibidores. Los inhibidores competitivos se unen reversiblemente en el sitio activo y, por lo tanto, compiten con el sustrato por la unión. A medida que aumenta la concentración de sustrato, puede superar al inhibidor permitiendo que la actividad enzimática alcance un máximo normal (línea verde). Un inhibidor no competitivo se une en un sitio separado del sitio activo, la actividad enzimática solo puede alcanzar una velocidad de reacción máxima inferior a la normal incluso a medida que aumenta la concentración de sustrato (línea azul). La inhibición no competitiva no está representada en esta parcela, pero sería similar a la del inhibidor no competitivo, alcanzando una tasa máxima menor. (Figura de OpenStax Biology)
Los estudios de inhibición competitiva han proporcionado información útil sobre ciertos complejos enzima-sustrato y las interacciones de grupos específicos en los sitios activos. Como resultado, las compañías farmacéuticas han sintetizado fármacos que inhiben competitivamente los procesos metabólicos en bacterias y ciertas células cancerosas. Muchos fármacos son inhibidores competitivos de enzimas específicas.
Un ejemplo clásico de inhibición competitiva es el efecto del malonato sobre la actividad enzimática de la succinato deshidrogenasa (Figura\(\PageIndex{2}\)). El malonato y el succinato son los aniones de los ácidos dicarboxílicos y contienen tres y cuatro átomos de carbono, respectivamente. La molécula de malonato se une al sitio activo debido a que el espaciamiento de sus grupos carboxilo no es muy diferente al del succinato. Sin embargo, no se produce ninguna reacción catalítica debido a que el malonato no tiene un grupo CH 2 CH 2 para convertir a CH=CH. Esta reacción también se discutirá en relación con el ciclo de Krebs y la producción de energía en un capítulo posterior.
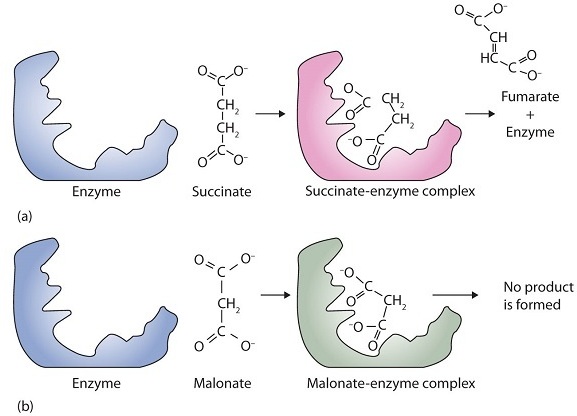
En la inhibición competitiva, el inhibidor solo puede unirse a la enzima cuando el sustrato ya está unido, es decir, se une al complejo enzima-sustrato pero no a la enzima sola. La velocidad máxima de reacción en presencia de un inhibidor no competitivo se reduce, sin embargo, a diferencia de la inhibición competitiva, la velocidad no puede aumentarse agregando más sustrato. Este tipo de inhibición se ve más comúnmente cuando la reacción enzimática involucra dos sustratos y mientras la concentración de inhibidor permanezca constante, la velocidad máxima de reacción no cambia.
Un inhibidor no competitivo puede unirse a la enzima libre o al complejo enzima-sustrato porque su sitio de unión en la enzima es distinto del sitio activo. La unión de este tipo de inhibidor altera la conformación tridimensional de la enzima, cambiando la configuración del sitio activo con uno de dos resultados. O bien el complejo enzima-sustrato no se forma a su velocidad normal, o bien, una vez formado, no produce productos a la velocidad normal (ver Figura\(\PageIndex{1}\)). Debido a que el inhibidor no se parece estructuralmente al sustrato, ni compite con el sustrato por el sitio activo, la adición de sustrato en exceso no revierte el efecto inhibidor.
La quimioterapia es el uso estratégico de sustancias químicas (es decir, drogas) para destruir microorganismos infecciosos o células cancerosas sin causar daños excesivos a las otras células sanas del huésped. Desde las bacterias hasta los humanos, las vías metabólicas de todos los organismos vivos son bastante similares, por lo que la búsqueda de agentes quimioterapéuticos seguros y efectivos es una tarea formidable. Muchos fármacos quimioterapéuticos bien establecidos funcionan inhibiendo una enzima crítica en las células del organismo invasor.
Un antibiótico es un compuesto que mata bacterias; puede provenir de una fuente natural como los mohos o ser sintetizado con una estructura análoga a un compuesto antibacteriano natural. Los antibióticos no constituyen una clase bien definida de sustancias químicamente relacionadas, pero muchos de ellos funcionan inhibiendo eficazmente una variedad de enzimas esenciales para el crecimiento bacteriano.
La penicilina, uno de los antibióticos más utilizados en el mundo, fue descubierta fortuitamente por Alexander Fleming en 1928, cuando notó propiedades antibacterianas en un moho que crecía en una placa de cultivo bacteriano. En 1938, Ernst Chain y Howard Florey comenzaron un intenso esfuerzo para aislar la penicilina del moho y estudiar sus propiedades. Las grandes cantidades de penicilina necesarias para esta investigación estuvieron disponibles a través del desarrollo de un medio nutritivo a base de maíz que el moho amaba y mediante el descubrimiento de una cepa de moho de mayor rendimiento en un centro de investigación del Departamento de Agricultura de los Estados Unidos cerca de Peoria, Illinois. Aun así, no fue hasta 1944 cuando se producían grandes cantidades de penicilina y se ponían a disposición para el tratamiento de infecciones bacterianas.
La penicilina funciona interfiriendo con la síntesis de las paredes celulares de bacterias reproductoras. Lo hace inhibiendo una enzima, la transpeptidasa, que cataliza el último paso en la biosíntesis de la pared celular bacteriana. Las paredes defectuosas hacen que las células bacterianas estaquen. Las células humanas no se ven afectadas porque tienen membranas celulares, no paredes celulares.
Se han aislado varias penicilinas naturales. Se distinguen por diferentes grupos R conectados a una estructura común: una amida cíclica de cuatro miembros (llamada anillo de lactama) fusionada a un anillo de cinco miembros. La adición de compuestos orgánicos apropiados al medio de cultivo conduce a la producción de los diferentes tipos de penicilina.
Las penicilinas son efectivas contra bacterias grampositivas (bacterias capaces de teñirse por tinción de Gram) y algunas bacterias gramnegativas (incluida la bacteria intestinal Escherichia coli). Son eficaces en el tratamiento de la difteria, gonorrea, neumonía, sífilis, muchas infecciones de pus y ciertos tipos de forúnculos. La penicilina G fue la penicilina más temprana que se utilizó a gran escala. Sin embargo, no se puede administrar por vía oral porque es bastante inestable; el pH ácido del estómago lo convierte en un derivado inactivo. Las principales penicilinas orales —penicilina V, ampicilina y amoxicilina—por otro lado, son estables a los ácidos.
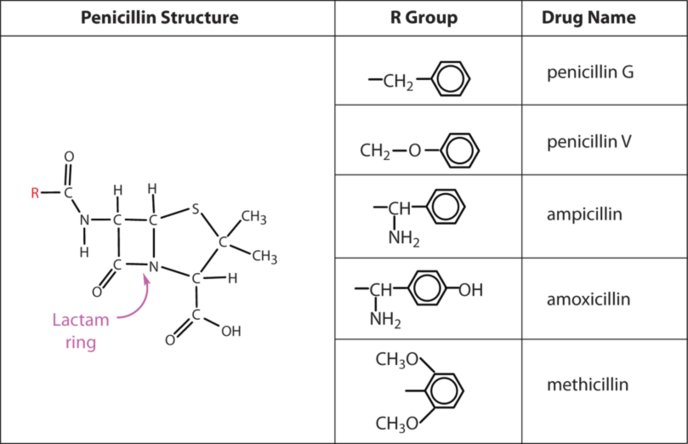
Algunas cepas de bacterias se vuelven resistentes a la penicilina a través de una mutación que les permite sintetizar una enzima, la penicilinasa, que descompone el antibiótico (por escisión del enlace amida en el anillo de lactama). Para combatir estas cepas, los científicos han sintetizado análogos de penicilina (como la meticilina) que no son inactivados por la penicilinasa.
Algunas personas (quizás el 5% de la población) son alérgicas a la penicilina y por lo tanto deben ser tratadas con otros antibióticos. Su reacción alérgica puede ser tan grave que puede ocurrir un coma fatal si se les administra penicilina inadvertidamente. Afortunadamente, se han descubierto varios otros antibióticos. La mayoría, incluyendo aureomicina y estreptomicina, son los productos de la síntesis microbiana. Otras, como las penicilinas semisintéticas y las tetraciclinas, se realizan mediante modificaciones químicas de antibióticos; y algunas, como el cloranfenicol, se fabrican íntegramente por síntesis química. Son tan eficaces como la penicilina en la destrucción de microorganismos infecciosos. Muchos de estos antibióticos ejercen sus efectos bloqueando la síntesis de proteínas en microorganismos.
Inicialmente, los antibióticos se consideraban medicamentos milagrosos, reduciendo sustancialmente el número de muertes por envenenamiento de la sangre, neumonía y otras enfermedades infecciosas. Hace unas siete décadas, una persona con una infección importante casi siempre murió. Hoy en día, tales muertes son raras. Hace siete décadas, la neumonía era un temido asesino de personas de todas las edades. Hoy en día, mata sólo a los muy viejos o a los enfermos por otras causas. De hecho, los antibióticos han hecho milagros en nuestro tiempo, pero incluso los medicamentos milagrosos tienen limitaciones. Poco después de que se usaran los medicamentos por primera vez, los organismos de enfermedades comenzaron a desarrollar cepas resistentes a ellos. En una carrera por adelantarse a las cepas bacterianas resistentes, los científicos continúan buscando nuevos antibióticos. Las penicilinas ahora han sido parcialmente desplazadas por compuestos relacionados, como las cefalosporinas y la vancomicina. Desafortunadamente, algunas cepas de bacterias ya han mostrado resistencia a estos antibióticos.
Inhibición irreversible
Un inhibidor irreversible inactiva una enzima uniéndose covalentemente a un grupo particular en el sitio activo. Cuando se une el inhibidor, el sitio activo de la enzima se bloquea, el sustrato no se une y no se puede producir catálisis, similar a la inhibición competitiva. La diferencia aquí es que la inhibición es irreversible, lo que significa que el inhibidor permanece unido y no se disocia de la enzima porque los enlaces covalentes enzima-inhibidor no se rompen fácilmente. En presencia de un inhibidor irreversible, el sustrato no puede unirse al sitio activo en absoluto, ni las altas concentraciones de sustrato pueden superar al inhibidor, de ahí que la enzima esté completamente inactivada. Muchos de los inhibidores irreversibles conocidos son venenos porque inactivan una enzima por completo. Algunos ejemplos se proporcionan en la Tabla\(\PageIndex{1}\) siguiente.
| Veneno | Fórmula | Ejemplo de enzima inhibida | Acción |
|---|---|---|---|
| arseniato | \(\ce{AsO4^{3−}}\) | gliceraldehído 3-fosfato deshidrogenasa | sustitutos del fosfato |
| yodoacetato | \(\ce{ICH2COO^{−}}\) | triosa fosfato deshidrogenasa | se une al\(\ce{SH}\) grupo cisteína |
| diisopropilfluoro-fosfato (DIFP; un veneno para los nervios) | 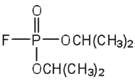 |
acetilcolinesterasa | se une al\(\ce{OH}\) grupo serina |
Resumen
Un inhibidor irreversible inactiva una enzima uniéndose covalentemente a un grupo particular en el sitio activo. Un inhibidor reversible inactiva una enzima a través de interacciones no covalentes y reversibles. Un inhibidor competitivo compite con el sustrato por la unión en el sitio activo de la enzima. Un inhibidor no competitivo se une en un sitio distinto del sitio activo.
Ejercicios de Revisión de Conceptos
- ¿Cuáles son las características de un inhibidor irreversible?
- ¿De qué manera se diferencia un inhibidor competitivo de un inhibidor no competitivo?
RESPUESTAS
- Inactiva una enzima uniéndose covalentemente a un grupo particular en el sitio activo.
- Un inhibidor competitivo se asemeja estructuralmente al sustrato para una enzima dada y compite con el sustrato por la unión en el sitio activo de la enzima. Un inhibidor no competitivo se une en un sitio distinto del sitio activo y puede unirse a la enzima libre o al complejo enzima-sustrato.
Ejercicios
- ¿Qué aminoácido está presente en el sitio activo de todas las enzimas que son inhibidas irreversiblemente por gases nerviosos como DIFP?
- Oxaloacetato (OOCCH2COO) inhibe la succinato deshidrogenasa. ¿Esperarías que el oxaloacetato sea un inhibidor competitivo o no competitivo? Explique.
Contestar
-
serina


