5.7: Líneas espectrales de hidrógeno atómico
- Page ID
- 70624
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
\( \newcommand{\id}{\mathrm{id}}\) \( \newcommand{\Span}{\mathrm{span}}\)
( \newcommand{\kernel}{\mathrm{null}\,}\) \( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\) \( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\) \( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\id}{\mathrm{id}}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\kernel}{\mathrm{null}\,}\)
\( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\)
\( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\)
\( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\) \( \newcommand{\AA}{\unicode[.8,0]{x212B}}\)
\( \newcommand{\vectorA}[1]{\vec{#1}} % arrow\)
\( \newcommand{\vectorAt}[1]{\vec{\text{#1}}} % arrow\)
\( \newcommand{\vectorB}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vectorC}[1]{\textbf{#1}} \)
\( \newcommand{\vectorD}[1]{\overrightarrow{#1}} \)
\( \newcommand{\vectorDt}[1]{\overrightarrow{\text{#1}}} \)
\( \newcommand{\vectE}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash{\mathbf {#1}}}} \)
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
¿Se puede arreglar un motor de automóvil?
Si bien es menos común en esta época, hubo una época en la que muchas personas podían trabajar en sus propios autos si había algún problema. Hoy en día, los motores están computarizados y requieren capacitación especializada y herramientas para ser fijos. Cuando la gente hacía sus propias reparaciones, a veces era un proceso de prueba y error. Tal vez las bujías necesitaban ser reemplazadas. No, eso no solucionó el problema por completo, pero fue un comienzo en la dirección correcta. La ciencia opera de la misma manera. Una teoría que se desarrolla puede funcionar por un tiempo, pero luego hay datos que la teoría no puede explicar. Esto significa que es hora de una teoría más nueva e inclusiva.
Líneas Espectrales de Hidrógeno
El modelo de Bohr explica las líneas espectrales del espectro de emisión atómica de hidrógeno. Mientras que el electrón del átomo permanece en el estado fundamental, su energía no cambia. Cuando el átomo absorbe uno o más cuantos de energía, el electrón se mueve desde la órbita del estado fundamental a una órbita de estado excitado que está más lejos. Los niveles de energía se designan con la variable\(n\). El estado base es\(n=1\), el primer estado excitado es\(n=2\), y así sucesivamente. La energía que obtiene el átomo es igual a la diferencia de energía entre los dos niveles de energía. Cuando el átomo se relaja de nuevo a un estado energético más bajo, libera energía que nuevamente es igual a la diferencia de energía de las dos órbitas (ver más abajo).

El cambio en la energía,\(\Delta E\), luego se traduce en luz de una frecuencia particular que se emite de acuerdo con la ecuación\(E = h \nu\). Recordemos que el espectro de emisión atómica del hidrógeno tenía líneas espectrales que constaban de cuatro frecuencias diferentes. Esto se explica en el modelo de Bohr al darse cuenta de que las órbitas de electrones no están igualmente espaciadas. A medida que la energía aumenta cada vez más del núcleo, el espaciamiento entre los niveles se hace cada vez más pequeño.
Con base en las longitudes de onda de las líneas espectrales, Bohr pudo calcular las energías que tendría el electrón de hidrógeno en cada uno de sus niveles de energía permitidos. Luego mostró matemáticamente qué transiciones de nivel de energía corresponden a las líneas espectrales en el espectro de emisión atómica (ver abajo).
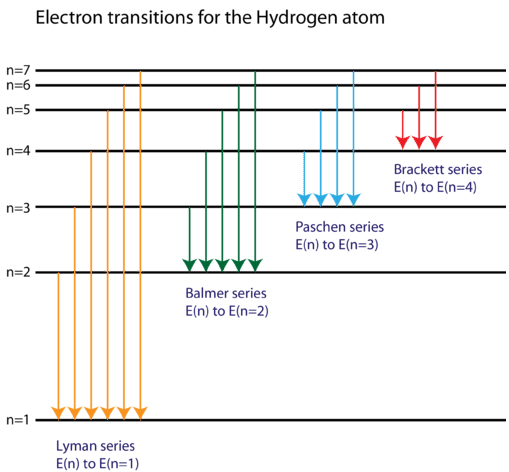
Encontró que las cuatro líneas espectrales visibles correspondían a transiciones desde niveles de energía más altos hasta el segundo nivel de energía\(\left( n=2 \right)\). A esto se le llama la serie Balmer. Las transiciones que terminan en el estado\(\left( n=1 \right)\) fundamental se llaman la serie Lyman, pero las energías liberadas son tan grandes que las líneas espectrales están todas en la región ultravioleta del espectro. Las transiciones llamadas serie Paschen y serie Brackett dan como resultado líneas espectrales en la región infrarroja, porque las energías son demasiado pequeñas.
El modelo de Bohr fue un tremendo éxito al explicar el espectro del átomo de hidrógeno. Desafortunadamente, cuando las matemáticas del modelo se aplicaron a átomos con más de un electrón, no fue capaz de predecir correctamente las frecuencias de las líneas espectrales. Si bien el modelo de Bohr representó un gran avance en el modelo atómico y el concepto de transiciones electrónicas entre niveles de energía es válido, se necesitaron mejoras para comprender completamente todos los átomos y su comportamiento químico.
Resumen
- Las líneas de emisión para hidrógeno corresponden a cambios de energía relacionados con las transiciones electrónicas.
- El modelo de Bohr funciona solo para el átomo de hidrógeno.
Revisar
- ¿Qué sucede cuando un átomo de hidrógeno absorbe uno o más cuantos de energía?
- ¿Cómo detectamos el cambio en la energía?
- ¿Qué transiciones electrónicas presentan las líneas de la serie Paschen?
- ¿El modelo Bohr funciona para átomos distintos del hidrógeno?

