6.3: Ley Periódica
- Page ID
- 70537
¿Cómo se relacionan estos artículos entre sí?
Todos hemos disfrutado buscando en un mercado alimentos deliciosos para comer más tarde en casa. Cuando llegas al mercado sabes que necesitas obtener frutas, verduras y granos para asegurarte de llevar una dieta equilibrada. En el mercado, estos artículos están todos agrupados para que sea más fácil encontrar el tipo de fruta, verdura o grano que estás buscando; sería inconveniente que las diferentes frutas estuvieran todas dispersas en diferentes lugares. La tabla periódica se organiza de manera similar, asegurando que elementos similares se encuentren en un mismo grupo o periodo.
La Ley Periódica
Cuando Mendeleev armó su tabla periódica, nadie sabía de la existencia del núcleo. No fue hasta 1911 que Rutherford realizó su experimento de lámina de oro que demostró la presencia del núcleo en el átomo. Apenas dos años después, en 1913, el físico inglés Henry Moseley (1887-1915) examinó los espectros de rayos X de una serie de elementos químicos. Dispararía rayos X a través de cristales del elemento y estudiaría las longitudes de onda de la radiación que detectó. Moseley encontró que había una relación entre longitud de onda y número atómico. Sus resultados llevaron a la definición del número atómico como el número de protones contenidos en el núcleo de cada átomo. Luego se dio cuenta de que los elementos de la tabla periódica debían estar dispuestos en orden de aumentar el número atómico, en lugar de aumentar la masa atómica.
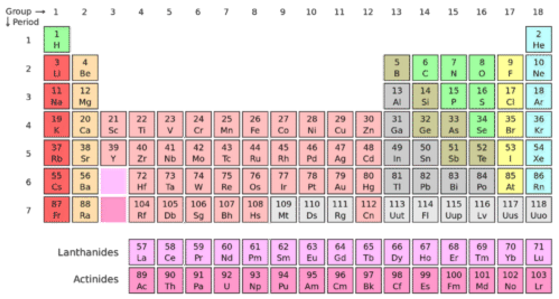
Al ordenarse por número atómico, desaparecieron las discrepancias dentro de la mesa de Mendeleev. El telurio tiene un número atómico de 52, mientras que el yodo tiene un número atómico de 53. Entonces, aunque el telurio efectivamente tiene una masa atómica mayor que el yodo, se coloca adecuadamente antes que el yodo en la tabla periódica. A Mendeleev y Moseley se les atribuye ser los más responsables de la ley periódica moderna: Cuando los elementos se disponen en orden de aumentar el número atómico, hay una repetición periódica de sus propiedades químicas y físicas. El resultado es la tabla periódica tal y como la conocemos hoy. Cada nueva fila horizontal de la tabla periódica corresponde al inicio de un nuevo periodo debido a que se está llenando de electrones un nuevo nivel de energía principal. Elementos con propiedades químicas similares aparecen a intervalos regulares, dentro de las columnas verticales llamadas grupos.
Resumen
- Los elementos de la tabla periódica se organizan en orden de aumento del número atómico.
- La ley periódica establece: “Cuando los elementos se disponen en orden de aumento del número atómico, hay una repetición periódica de sus propiedades químicas y físicas”.
Revisar
- ¿Conocía Mendeleev el núcleo de un átomo?
- ¿Quién descubrió la relación entre longitud de onda de los rayos X y número atómico?
- ¿Qué concluyó Moseley de su investigación?
- ¿Qué es la “ley periódica”?
- ¿Qué representan las columnas verticales (grupos) de la tabla periódica?

