6.18: Blindaje de electrones
- Page ID
- 70530
¿Cuál es el objetivo de un juego de roller derby?
El roller derby es un deporte popular, aunque no es familiar para mucha gente. El propósito básico es poner a un miembro del equipo (el “jammer”) más allá del equipo contrario para anotar puntos. Otros miembros del equipo sirven como bloqueadores para evitar que el equipo contrario detenga el jammer. Los bloqueadores interfieren en la interacción entre el jammer y los oponentes al meterse entre el jammer y los patinadores tratando de detenerlos.
La atracción entre un electrón y el núcleo del átomo no es un tema sencillo. Solo con hidrógeno existe una relación uno a uno que pueda discutirse en términos de atracción directa de carga. A medida que aumenta el tamaño del átomo, también aumenta el número de protones y electrones. Estos cambios influyen en cómo el núcleo atrae electrones.
Blindaje de electrones
En general, la energía de ionización de un átomo aumentará a medida que nos movemos de izquierda a derecha a través de la tabla periódica. Hay varias excepciones al aumento general de la energía de ionización a lo largo de un período. Los elementos del Grupo 13 (\(\ce{B}\),\(\ce{Al}\), etc.) tienen energías de ionización menores que los elementos del Grupo 2 (\(\ce{Be}\)\(\ce{Mg}\),, etc.). Esto es una ilustración de un concepto llamado "blindaje electrónico”. Los electrones externos están parcialmente protegidos de la fuerza de atracción de los protones en el núcleo por electrones internos.
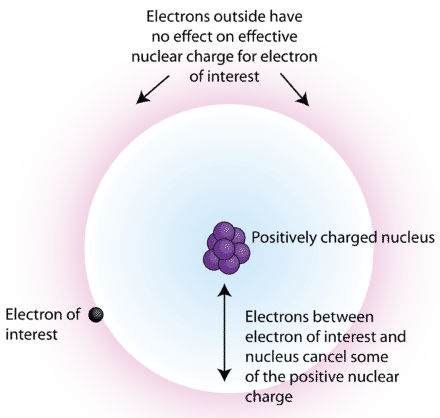
Para explicar cómo funciona el blindaje, considere un átomo de litio. Tiene tres protones y tres electrones, dos en el primer nivel de energía principal y su electrón de valencia en el segundo. El electrón de valencia está parcialmente protegido de la fuerza de atracción del núcleo por los dos electrones internos. Eliminar ese electrón de valencia se vuelve más fácil debido al efecto de blindaje.
También hay un efecto de blindaje que ocurre entre subniveles dentro del mismo nivel de energía principal. Específicamente, un electrón en el\(s\) subnivel es capaz de blindar electrones en el\(p\) subnivel del mismo nivel de energía principal. Esto se debe a la forma esférica de la\(s\) órbita. Lo contrario no es cierto: los electrones en los\(p\) orbitales no blindan electrones en\(s\) los orbitales.
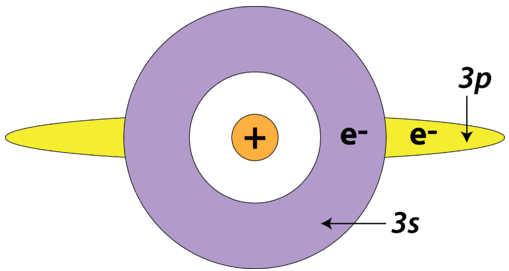
El electrón que se elimina de un\(\ce{Al}\) átomo es un\(3p\) electrón, que está blindado por los dos\(3s\) electrones, así como por todos los electrones del núcleo interno. El electrón que se elimina de un\(\ce{Mg}\) átomo es un\(3s\) electrón, que solo está blindado por los electrones del núcleo interno. Dado que existe un mayor grado de blindaje electrónico en el\(\ce{Al}\) átomo, es ligeramente más fácil eliminar el electrón de valencia; su energía de ionización es menor que la de\(\ce{Mg}\). Esto a pesar de que el núcleo del\(\ce{Al}\) átomo contiene un protón más que el núcleo del\(\ce{Mg}\) átomo.
Existe otra anomalía entre los Grupos 15 y 16. Los átomos del Grupo 16 (\(\ce{O}\)\(\ce{S}\),, etc.) tienen energías de ionización menores que los átomos del Grupo 15 (\(\ce{N}\)\(\ce{P}\),, etc.). La regla de Hund está detrás de la explicación. En un átomo de nitrógeno, hay tres electrones en el\(2p\) subnivel y cada uno está desapareado. En un átomo de oxígeno, hay cuatro electrones en el\(2p\) subnivel, por lo que un orbital contiene un par de electrones. Es ese segundo electrón en el orbital el que se elimina en la ionización de un átomo de oxígeno. Dado que los electrones se repelen entre sí, es un poco más fácil eliminar el electrón del conjunto emparejado en el átomo de oxígeno que eliminar un electrón desapareado del átomo de nitrógeno.
Resumen
- El blindaje de electrones se refiere al bloqueo de la atracción de electrones de la capa de valencia por el núcleo, debido a la presencia de electrones de capa interna.
- Los electrones en un\(s\) orbital pueden blindar\(p\) electrones al mismo nivel de energía debido a la forma esférica del\(s\) orbital.
- Los electrones en configuraciones de espín emparejado son ligeramente más fáciles de eliminar que los electrones desapareados.
Revisar
- Define “blindaje de electrones”.
- ¿Por qué los elementos del grupo 13 tienen energías de ionización menores que los elementos del grupo 2?
- ¿Qué influencia tiene un mayor efecto de blindaje en la energía de ionización?
- ¿Cómo afectan los electrones de la órbita s a la energía de ionización de un electrón p en la misma capa?
- ¿Por qué los átomos del grupo 16 tienen energías de ionización inferiores a las del grupo 15 átomos correspondientes?

