7.11: Compuestos moleculares binarios: Nombramiento y fórmulas
- Page ID
- 70811
¿Por qué tantos familiares en la realeza comparten el mismo nombre?
Algunas familias nombran a un hijo (generalmente el primogénito) en honor a su padre. Entonces, es algo común conocer a un John Smith, Jr. que lleva el nombre de John Smith el padre. Ciertas familias pueden nombrar a un nieto Juan Smith III. Los países con largas historias de realeza llevan el nombre aún más lejos. Una línea de reyes llamada Henry va hasta Enrique el Octavo (no es el tipo más amable del mundo, tenía seis esposas y dos de ellas se encontraron con fines inoportunos). El uso de la numeración para los nombres agrega claridad a un sistema, es fácilmente discernible de qué se habla de Henry.
Los compuestos químicos inorgánicos pueden clasificarse ampliamente en dos grupos: compuestos iónicos y compuestos moleculares. La estructura de todos los compuestos iónicos es una matriz tridimensional extendida de iones positivos y negativos alternos. Dado que los compuestos iónicos no toman la forma de moléculas individuales, están representados por fórmulas empíricas. Ahora comenzaremos a examinar las fórmulas y nomenclatura de los compuestos moleculares.
Compuestos Moleculares
Los compuestos moleculares son compuestos inorgánicos que toman la forma de moléculas discretas. Los ejemplos incluyen sustancias tan familiares como el agua\(\left( \ce{H_2O} \right)\) y el dióxido de carbono\(\left( \ce{CO_2} \right)\). Estos compuestos son muy diferentes de los compuestos iónicos como el cloruro de sodio\(\left( \ce{NaCl} \right)\). Los compuestos iónicos se forman cuando los átomos metálicos pierden uno o más de sus electrones a átomos no metálicos. Los cationes y aniones resultantes son atraídos electrostáticamente entre sí.
Entonces, ¿qué mantiene unidos los átomos de una molécula? En lugar de formar iones, los átomos de una molécula comparten sus electrones de valencia de tal manera que se forma un enlace entre pares de átomos. En una molécula de dióxido de carbono, hay dos de estos enlaces, cada uno ocurre entre el átomo de carbono y uno de los dos átomos de oxígeno.
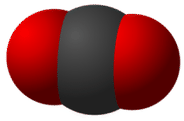
Las moléculas más grandes pueden tener muchos, muchos enlaces que sirven para mantener unida la molécula. En una muestra grande de un compuesto molecular dado, todas las moléculas individuales son idénticas.
Nombramiento de compuestos moleculares binarios
Recordemos que una fórmula molecular muestra el número de átomos de cada elemento que contiene una molécula. Una molécula de agua contiene dos átomos de hidrógeno y un átomo de oxígeno, por lo que su fórmula es\(\ce{H_2O}\). Una molécula de octano, que es un componente de la gasolina, contiene 8 átomos de carbono y 18 átomos de hidrógeno. La fórmula molecular del octano es\(\ce{C_8H_{18}}\).

Un compuesto molecular binario es un compuesto molecular que se compone de dos elementos. Los elementos que se combinan para formar compuestos moleculares binarios son ambos átomos no metálicos. Esto contrasta con los compuestos iónicos, que se forman a partir de un ión metálico y un ion no metálico. Por lo tanto, los compuestos moleculares binarios son diferentes porque las cargas iónicas no pueden usarse para nombrarlos o escribir sus fórmulas. Otra diferencia es que dos átomos no metálicos se combinarán frecuentemente entre sí en una variedad de proporciones. Considera los elementos nitrógeno y oxígeno. Se combinan para hacer varios compuestos incluyendo\(\ce{NO}\),\(\ce{NO_2}\), y\(\ce{N_2O}\). A todos no se les puede llamar óxido de nitrógeno. ¿Cómo sabría alguien de cuál estabas hablando? Cada uno de los tres compuestos tiene propiedades y reactividades muy diferentes. Es necesario un sistema para distinguir entre compuestos como estos.
Los prefijos se utilizan en los nombres de compuestos moleculares binarios para identificar el número de átomos de cada elemento. En la siguiente tabla se muestran los prefijos hasta diez.
| Número de átomos | Prefijo |
|---|---|
| 1 | mono |
| 2 | di- |
| 3 | tri- |
| 4 | tetra |
| 5 | penta |
| 6 | hexa- |
| 7 | hepta |
| 8 | octa |
| 9 | nona |
| 10 | deca- |
Las reglas para usar el sistema de prefijo de nomenclatura de compuestos binarios se pueden resumir de la siguiente manera:
- Generalmente, el elemento menos electronegativo se escribe primero en la fórmula, aunque hay algunas excepciones. El carbono siempre es el primero en una fórmula y el hidrógeno es después del nitrógeno en una fórmula como\(\ce{NH_3}\). El orden de los no metales comunes en las fórmulas compuestas binarias es\(\ce{C}\)\(\ce{P}\),\(\ce{N}\),\(\ce{H}\),\(\ce{S}\),\(\ce{I}\),\(\ce{Br}\),\(\ce{Cl}\),\(\ce{O}\),\(\ce{F}\).
- Al nombrar, el prefijo apropiado se usa sólo si hay más de un átomo de ese elemento en la fórmula.
- El segundo elemento lleva el nombre del primero, pero con el final del nombre del elemento cambiado a -ide. El prefijo apropiado siempre se usa para el segundo elemento.
- La a o o al final de un prefijo generalmente se elimina del nombre cuando el nombre del elemento comienza con una vocal. Como ejemplo, cuatro átomos de oxígeno son tetróxido en lugar de tetraóxido.
Algunos ejemplos de compuestos moleculares se enumeran en la Tabla\(\PageIndex{2}\).
| Fórmula | Nombre |
|---|---|
| \(\ce{NO}\) | monóxido de nitrógeno |
| \(\ce{N_2O}\) | monóxido de dinitrógeno |
| \(\ce{S_2Cl_2}\) | dicloruro de disulfur |
| \(\ce{Cl_2O_7}\) | heptoxido de diclorina |
Observe que el mono- prefijo no se usa con el nitrógeno en el primer compuesto, sino que se usa con el oxígeno en ambos de los dos primeros ejemplos. El\(\ce{S_2Cl_2}\) enfatiza que las fórmulas para compuestos moleculares no se reducen a sus proporciones más bajas. El o del mono- y el a de hepta- se dejan caer del nombre cuando se emparejan con óxido.
Resumen
- Los compuestos moleculares son compuestos inorgánicos que toman la forma de moléculas discretas.
- Los átomos de estos compuestos se mantienen unidos por enlaces covalentes.
- Los prefijos se utilizan para indicar el número de átomos de un elemento que se encuentran en el compuesto.
Revisar
- ¿Qué son los compuestos moleculares?
- ¿En qué se diferencian de los compuestos iónicos?
- ¿Qué mantiene unidos los átomos de una molécula?
- ¿Los elementos de los compuestos moleculares son metales o no metales?
- ¿Cuál es el prefijo para el número de átomos de un elemento cuando hay cuatro átomos de ese elemento en el compuesto?
- ¿Cuál es el prefijo para el número de átomos de un elemento cuando hay 7 átomos de ese elemento en el compuesto?
- Nombrar los siguientes compuestos:
- CLF 3
- Como 2 O 5
- B 4 H 10

