7.12: Ácidos - Nombramiento y Fórmulas
- Page ID
- 70878
¿Cómo se prueba el oro?
Una prueba puntual para el oro ha estado en uso durante décadas. La muestra se trata primero con ácido nítrico. Otros metales pueden reaccionar o disolverse en este ácido, pero el oro no lo hará. Después se agrega la muestra a una mezcla de ácido nítrico y ácido clorhídrico. El oro sólo se disolverá en esta mezcla. El término “prueba ácida” surgió de la fiebre del oro de California a fines de la década de 1840, cuando esta combinación se utilizó para probar la presencia de oro real. Desde entonces ha llegado a significar “probado y aprobado” en varios campos.
Ácidos
Un ácido se puede definir de varias maneras. La definición más directa es que un ácido es un compuesto molecular que contiene uno o más átomos de hidrógeno y produce iones de hidrógeno\(\left( \ce{H^+} \right)\) cuando se disuelve en agua.

Este es un tipo de compuesto diferente a los otros que hemos visto hasta ahora. Los ácidos son moleculares, lo que significa que en su estado puro son moléculas individuales y no adoptan las estructuras tridimensionales extendidas de compuestos iónicos como\(\ce{NaCl}\). Sin embargo, cuando estas moléculas se disuelven en agua, el enlace químico entre el átomo de hidrógeno y el resto de la molécula se rompe, dejando un ion hidrógeno cargado positivamente y un anión. Esto se puede simbolizar en una ecuación química:
\[\ce{HCl} \rightarrow \ce{H^+} + \ce{Cl^-}\nonumber \]
Dado que los ácidos producen\(\ce{H^+}\) cationes al disolverse en agua, el\(\ce{H}\) de un ácido se escribe primero en la fórmula de un ácido inorgánico. El resto del ácido (distinto del\(\ce{H}\)) es el anión después de que el ácido se disuelve. Los ácidos orgánicos también son una clase importante de compuestos, pero no se discutirán aquí. Un ácido binario es un ácido que consiste en hidrógeno y otro elemento. Los ácidos binarios más comunes contienen un halógeno. Un oxoácido es un ácido que consiste en hidrógeno, oxígeno y un tercer elemento. El tercer elemento suele ser un no metal.
Nombrar ácidos
Dado que todos los ácidos contienen hidrógeno, el nombre de un ácido se basa en el anión que lo acompaña. Estos aniones pueden ser monatómicos o poliatómicos. El nombre de todos los iones monatómicos termina en -ide. La mayoría de los iones poliatómicos terminan en -ato o -ite, aunque hay algunas excepciones como el ion cianuro\(\left( \ce{CN^-} \right)\). Es el sufijo del anión el que determina cómo se nombra al ácido, tal y como se muestra en las reglas y tabla a continuación.
| Sufijo Anión | Ejemplo | Nombre del ácido | Ejemplo |
|---|---|---|---|
| -ide | cloruro\(\left( \ce{Cl^-} \right)\) | ácido hidro_____ic | ácido clorhídrico\(\left( \ce{HCl} \right)\) |
| -ate | sulfato\(\left( \ce{SO_4^{2-}} \right)\) | ______ácido ic | ácido sulfúrico\(\left( \ce{H_2SO_4} \right)\) |
| -ite | nitrito\(\left( \ce{NO_2^-} \right)\) | ácido ____oso | ácido nitroso\(\left( \ce{HNO_2} \right)\) |
Los tres sufijos diferentes que son posibles para los aniones conducen a tres reglas:
- Cuando el anión termina en -ide, el nombre ácido comienza con el prefijo hydro-. La raíz del nombre del anión va en blanco (cloro para cloruro), seguida del sufijo -ic. \(\ce{HCl}\)es ácido clorhídrico porque\(\ce{Cl^-}\) es el ion cloruro. \(\ce{HCN}\)es ácido cianhídrico porque\(\ce{CN^-}\) es el ion cianuro.
- Cuando el anión termina en -ato, el nombre del ácido es la raíz del anión seguido del sufijo -ic. No hay prefijo. \(\ce{H_2SO_4}\)es ácido sulfúrico (no sulfic) porque\(\ce{SO_4^{2-}}\) es el ion sulfato.
- Cuando el anión termina en -ite, el nombre del ácido es la raíz del anión seguido del sufijo -ous. Nuevamente, no hay prefijo. \(\ce{HNO_2}\)es ácido nitroso porque\(\ce{NO_2^-}\) es el ion nitrito.
Observe cómo la raíz de un oxoácido que contiene azufre es azufre- en lugar de solo sulf-. Lo mismo es cierto para un oxoácido que contiene fósforo. La raíz es fósforo- en lugar de simplemente fosfo-.
Muchos alimentos y bebidas contienen ácido cítrico. El vinagre es una solución diluida de ácido acético. Las baterías de los autos contienen ácido sulfúrico que ayuda en la liberación de electrones para crear electricidad.
Escribir Fórmulas para Ácidos
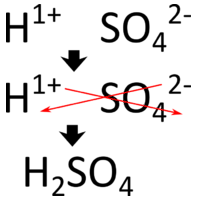
Al igual que otros compuestos que hemos estudiado, los ácidos son eléctricamente neutros. Por lo tanto, la carga de la parte aniónica de la fórmula debe ser equilibrada exactamente por los\(\ce{H^+}\) iones. Dado que\(\ce{H^+}\) los iones llevan una sola carga positiva, el número de\(\ce{H^+}\) iones en la fórmula es igual a la cantidad de carga negativa en el anión. Dos ejemplos de la tabla anterior ilustran este punto. El ion cloruro lleva una\(1-\) carga, por lo que solo\(\ce{H}\) se necesita una en la fórmula del ácido\(\left( \ce{HCl} \right)\). El ion sulfato lleva una\(2-\) carga, por lo que se necesitan dos\(\ce{H}\) s en la fórmula del ácido\(\left( \ce{H_2SO_4} \right)\). Otra forma de escribir la fórmula correcta es utilizar el método entrecruzado, que se muestra a continuación para el ácido sulfúrico.
Resumen
- Los ácidos son compuestos moleculares que liberan iones de hidrógeno.
- Un ácido binario consiste en hidrógeno y otro elemento.
- Los oxoácidos contienen hidrógeno, oxígeno y otro elemento.
- El nombre del ácido se basa en el anión unido al hidrógeno.
- Escribir fórmulas para ácidos sigue las mismas reglas que para los compuestos iónicos binarios.
Revisar
- Define “ácido”.
- ¿Qué es un ácido binario?
- ¿Qué es un oxoácido?
- Nombrar los siguientes ácidos:
- H 2 SO 4
- HCN
- HCl
- H 3 PO 4
- Escriba fórmulas para los siguientes ácidos:
- ácido bromhídrico
- ácido perclórico
- ácido nitroso

