8.6: Unión Iónica
- Page ID
- 70951
¿El mar realmente tiene sal en él?
Podemos obtener sal de mesa común de varias fuentes. Se puede extraer en forma sólida en minas de sal, o encontrarse como un sólido en depósitos. También podemos obtener sal del océano, pero realmente no existe como sal cuando está en solución. Los iones sodio y cloruro se disuelven, pero no se combinan en una estructura hasta que se elimina toda el agua.
La mayoría de las rocas y minerales que componen la corteza terrestre están compuestas por iones positivos y negativos que se mantienen unidos por enlaces iónicos. Un compuesto iónico es un compuesto eléctricamente neutro que consiste en iones positivos y negativos. Usted está muy familiarizado con algunos compuestos iónicos, como el cloruro de sodio\(\left( \ce{NaCl} \right)\). Un cristal de cloruro de sodio consiste en números iguales de iones de sodio positivos\(\left( \ce{Na^+} \right)\) e iones de cloruro negativos\(\left( \ce{Cl^-} \right)\).
Enlaces Ionicos
Las partículas con carga de oposición se atraen entre sí. Esta fuerza de atracción a menudo se conoce como una fuerza electrostática. Un enlace iónico es la fuerza electrostática que mantiene los iones juntos en un compuesto iónico. La fuerza del enlace iónico depende directamente de la cantidad de cargas e inversamente depende de la distancia entre las partículas cargadas. Un catión con una\(2+\) carga hará un enlace iónico más fuerte que un catión con una\(1+\) carga. Un ion más grande hace un enlace iónico más débil debido a la mayor distancia entre sus electrones y el núcleo del ion cargado opositivamente.
Diagramas de punto electrónico
Utilizaremos cloruro de sodio como ejemplo para demostrar la naturaleza del enlace iónico y cómo se forma. Como saben, el sodio es un metal y pierde su único electrón de valencia para convertirse en catión. El cloro es un no metal y gana un electrón al convertirse en un anión. Ambos logran una configuración de electrones de gas noble-gas. Sin embargo, los electrones no pueden simplemente “perderse” a ninguna parte en particular. Una forma más precisa de describir lo que está sucediendo es que un solo electrón se transfiere del átomo de sodio al átomo de cloro, como se muestra a continuación.
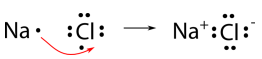
El enlace iónico es la atracción del\(\ce{Na^+}\) ion por el\(\ce{Cl^-}\) ion. Es convencional mostrar el catión sin puntos alrededor del símbolo para enfatizar que el nivel de energía original que contenía el electrón de valencia ahora está vacío. El anión se muestra ahora con un octeto completo de electrones.
Para un compuesto como el cloruro de magnesio, no es tan sencillo. Debido a que el magnesio tiene dos electrones de valencia, necesita perder ambos para lograr la configuración de gas noble-gas. Por lo tanto, se necesitarán dos átomos de cloro.
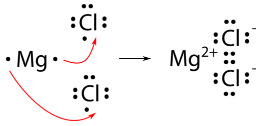
La fórmula final para el cloruro de magnesio es\(\ce{MgCl_2}\).
Resumen
- Un compuesto iónico contiene iones positivos y negativos.
- Un enlace iónico es de naturaleza electrostática.
- Los diagramas de puntos electrónicos se pueden utilizar para ilustrar los movimientos de electrones y la formación de iones.
Revisar
- ¿Qué es un compuesto iónico?
- ¿Qué es un enlace iónico?
- ¿Qué catión (Na + o Ca 2 +) formaría un enlace iónico más fuerte con Cl -?

