8.10: Adhesión Metálica
- Page ID
- 70881

¿Por qué los metales se comportan de la manera que lo hacen
La imagen de abajo es de una placa de cobre que se hizo en 1893. El utensilio tiene una gran cantidad de decoración elaborada, y el artículo es muy útil. ¿Qué hubiera pasado si esta placa estuviera hecha de cloruro de cobre (I) en su lugar? El cloruro de cobre (I) sí contiene cobre, después de todo. No obstante, el\(\ce{CuCl}\) terminaría como un polvo cuando un metalero lo machacara para darle forma. Los metales se comportan de maneras únicas. La unión que se produce en un metal es responsable de sus propiedades distintivas: brillo, maleabilidad, ductilidad y excelente conductividad.
El enlace metálico
Los metales puros son sólidos cristalinos, pero a diferencia de los compuestos iónicos, cada punto de la red cristalina está ocupado por un átomo idéntico. Los electrones en los niveles de energía externa de un metal son móviles y capaces de derivar de un átomo de metal a otro. Esto significa que el metal se ve más adecuadamente como una matriz de iones positivos rodeados por un mar de electrones de valencia móvil. Los electrones que son capaces de moverse libremente a través de los orbitales vacíos del cristal metálico se denominan electrones deslocalizados (ver más abajo). Un enlace metálico es la atracción de los cationes metálicos estacionarios hacia los electrones móviles circundantes.
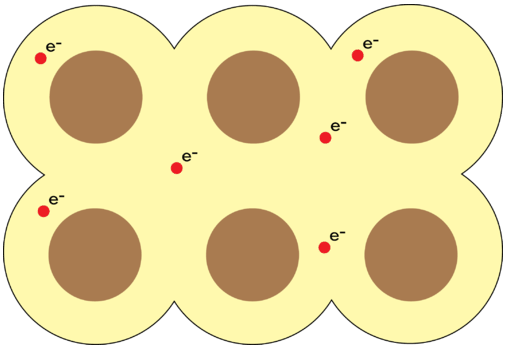
Propiedades de los Metales
El modelo de unión metálica explica las propiedades físicas de los metales. Los metales conducen muy bien la electricidad y el calor debido a sus electrones que fluyen libremente. A medida que los electrones entran en un extremo de una pieza de metal, un número igual de electrones fluye hacia afuera desde el otro extremo. Cuando la luz brilla sobre la superficie de un metal, sus electrones absorben pequeñas cantidades de energía y se excitan en uno de sus muchos orbitales vacíos. Los electrones vuelven a caer inmediatamente a niveles de energía más bajos y emiten luz. Este proceso es responsable del alto brillo de los metales.

Recordemos que los compuestos iónicos son muy quebradizos. La aplicación de una fuerza da como resultado iones de carga similar en el cristal que se acercan demasiado entre sí, lo que hace que el cristal se haga añicos. Cuando se aplica una fuerza a un metal, los electrones que fluyen libremente pueden deslizarse entre los cationes estacionarios y evitar que entren en contacto. Imagine rodamientos de bolas que han sido recubiertos con aceite deslizándose uno al otro. Como resultado, los metales son muy maleables y dúctiles. Pueden ser martillados en formas, enrollados en láminas delgadas o tirados en alambres delgados.
Resumen
- El enlace metálico es responsable de las propiedades de los metales.
- Los metales conducen bien la electricidad y el calor.
- Los metales son dúctiles y maleables.
- Los metales tienen brillo.
Revisar
- ¿Qué es un electrón deslocalizado?
- ¿Por qué los metales conducen bien la electricidad y el calor?
- ¿Por qué los metales tienen brillo?

