8.9: Propiedades físicas de los compuestos iónicos
- Page ID
- 70867
¿Qué produce cristales de colores?
La figura anterior muestra solo algunos ejemplos del color y brillo de los cristales iónicos naturales. La disposición regular y ordenada de los iones en la red cristalina es responsable de las diversas formas de estos cristales, mientras que los iones de metales de transición dan lugar a los colores.
Propiedades físicas de los compuestos iónicos
Puntos de fusión
Debido a las muchas atracciones simultáneas entre cationes y aniones que ocurren, las celosías cristalinas iónicas son muy fuertes. El proceso de fusión de un compuesto iónico requiere la adición de grandes cantidades de energía para romper todos los enlaces iónicos en el cristal. Por ejemplo, el cloruro de sodio tiene una temperatura de fusión de aproximadamente\(800^\text{o} \text{C}\).
Rompiendo
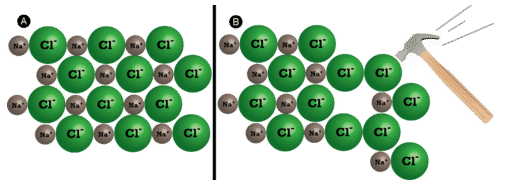
Los compuestos iónicos son generalmente duros, pero quebradizos. ¿Por qué? Se necesita una gran cantidad de fuerza mecánica, como golpear un cristal con un martillo, para obligar a una capa de iones a desplazarse con relación a su vecino. No obstante, cuando eso sucede, trae iones de la misma carga uno al lado del otro (ver abajo). Las fuerzas repulsivas entre iones con carga similar hacen que el cristal se rompa. Cuando un cristal iónico se rompe, tiende a hacerlo a lo largo de planos lisos debido a la disposición regular de los iones.
Conductividad
Otra propiedad característica de los compuestos iónicos es su conductividad eléctrica. La siguiente figura muestra tres experimentos en los que dos electrodos que están conectados a una bombilla se colocan en vasos de precipitados que contienen tres sustancias diferentes.
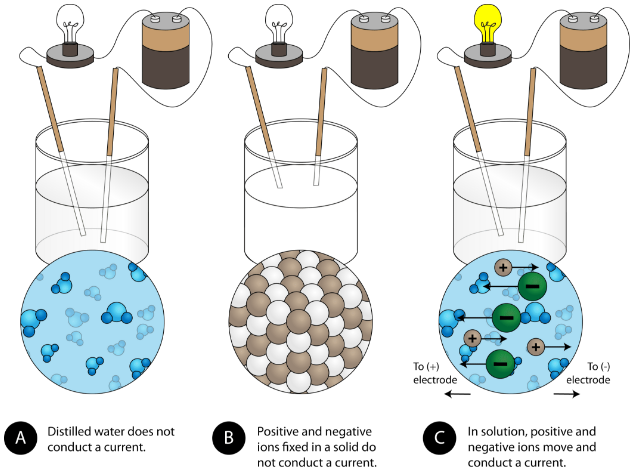
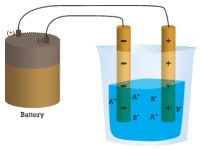
En el primer vaso de precipitados, el agua destilada no conduce corriente porque el agua es un compuesto molecular. En el segundo vaso de precipitados, el cloruro de sodio sólido tampoco conduce corriente. A pesar de ser iónica y así compuesta por partículas cargadas, la red cristalina sólida no permite que los iones se muevan entre los electrodos. Se requieren partículas cargadas móviles para que el circuito esté completo y la bombilla se encienda. En el tercer vaso de precipitados, el\(\ce{NaCl}\) ha sido disuelto en el agua destilada. Ahora la red cristalina se ha roto y los iones positivos y negativos individuales pueden moverse. Los cationes se mueven a un electrodo, mientras que los aniones se mueven hacia el otro, permitiendo que la electricidad fluya (ver figura abajo). La fusión de un compuesto iónico también libera los iones para conducir una corriente. Los compuestos iónicos conducen una corriente eléctrica cuando se funden o disuelven en agua.
Resumen
- Los compuestos iónicos tienen altos puntos de fusión.
- Los compuestos iónicos son duros y quebradizos.
- Las soluciones de compuestos iónicos y compuestos iónicos fundidos conducen la electricidad, pero los materiales sólidos no.
Revisar
- ¿Por qué los compuestos iónicos son quebradizos?
- ¿Por qué los puntos de fusión son altos para los compuestos iónicos?
- ¿Qué sucede cuando una corriente eléctrica pasa a través de una solución de un compuesto iónico?
Explora más
Vea el video a continuación y responda las siguientes preguntas:
- ¿Todos los compuestos iónicos forman cristales?
- ¿Los compuestos iónicos fundidos conducirán electricidad?
- ¿Cuáles son los puntos de fusión y ebullición de KI?


