9.4: Energía y Formación de Enlace Covalente
- Page ID
- 70396
¿Por qué BeCl 2 y LiCl se unen de manera diferente?
Hemos aprendido que las sales haluro de los elementos del grupo 1 son típicamente compuestos iónicos. \(\ce{LiCl}\)Esperaríamos existir como\(\ce{Li^+}\) cationes y\(\ce{Cl^-}\) aniones (y lo hace). Sin embargo, si movemos una columna hacia la derecha, el berilio vecino del litio forma un tipo diferente de enlace por completo. Este enlace consiste en electrones compartidos entre los\(\ce{Cl}\) átomos\(\ce{Be}\) y, no atracción electrostática entre iones.
Energía y Formación de Enlace Covalente
Los compuestos moleculares son aquellos que toman la forma de una molécula individual. Los compuestos moleculares generalmente están compuestos por dos o más átomos no metálicos. Los ejemplos familiares incluyen agua\(\left( \ce{H_2O} \right)\)\(\left( \ce{CO_2} \right)\), dióxido de carbono y amoníaco\(\left( \ce{NH_3} \right)\). Recordemos que la fórmula molecular muestra el número de cada átomo que se presenta en una molécula de ese compuesto. Una molécula de agua contiene dos átomos de hidrógeno y un átomo de oxígeno. \(\left( \ce{H_2} \right)\)El hidrógeno es un ejemplo de un elemento que existe naturalmente como molécula diatómica. Una molécula diatómica es una molécula que contiene dos átomos.
La mayoría de los átomos alcanzan una energía potencial menor cuando están unidos a otros átomos que cuando están separados. Considera dos átomos de hidrógeno aislados que están separados por una distancia lo suficientemente grande como para evitar cualquier interacción entre ellos. A esta distancia, se dice que la energía potencial del sistema es igual a cero (véase la figura a continuación).
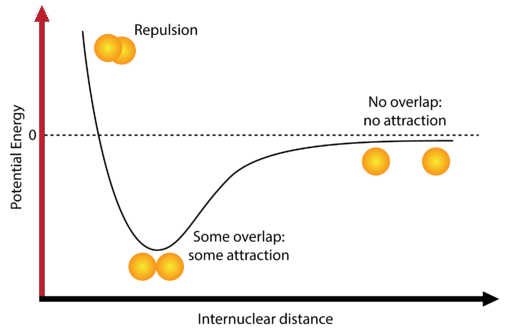
A medida que los átomos se acercan entre sí, sus nubes de electrones gradualmente comienzan a superponerse. Ahora hay varias interacciones que comienzan a ocurrir. Una es que los electrones individuales que posee cada átomo de hidrógeno comienzan a repelerse entre sí. Esta fuerza repulsiva tendería a hacer que la energía potencial del sistema aumente. Sin embargo, el electrón de cada átomo comienza a ser atraído hacia el núcleo del otro átomo. Esta fuerza atractiva tiende a hacer disminuir la energía potencial del sistema.
A medida que los átomos comienzan a interactuar por primera vez, la fuerza de atracción es más fuerte que la fuerza repulsiva y así la energía potencial del sistema disminuye, como se ve en el diagrama. Recuerde que la menor energía potencial aumenta la estabilidad del sistema. A medida que los dos átomos de hidrógeno se acercan cada vez más, la energía potencial se encuentra en su punto más bajo posible. Si los átomos de hidrógeno se acercan más, comienza a dominar una tercera interacción, y esa es la fuerza repulsiva entre los dos núcleos cargados positivamente. Esta fuerza repulsiva es muy fuerte, como puede verse por el fuerte aumento de la energía en el extremo izquierdo del diagrama.
El punto en el que la energía potencial alcanzó su mínimo representa la distancia ideal entre los átomos de hidrógeno para que se produzca un enlace químico estable. Este tipo de enlace químico se denomina enlace covalente. Un enlace covalente es un enlace en el que dos átomos comparten uno o más pares de electrones. Los electrones individuales de cada uno de los dos átomos de hidrógeno se comparten cuando los átomos se unen para formar una molécula de hidrógeno\(\left( \ce{H_2} \right)\).
Resumen
- Los enlaces covalentes se forman cuando los átomos comparten electrones entre ellos.
Revisar
- ¿Qué es una molécula diatómica?
- ¿Qué le hace a un sistema una menor energía potencial?
- ¿Cuál es la distancia ideal para dos átomos?

