9.5: Estructuras de punto de electrones de Lewis
- Page ID
- 70392
¿Qué aspecto tiene realmente el colesterol?
Podemos escribir la estructura de la molécula de colesterol de un par de maneras diferentes. El enfoque más sencillo es simplemente escribir\(\ce{C_{27}H_{46}O}\). Esta “estructura” no es muy útil porque no nos dice cómo los carbonos, hidrógenos y oxígeno están conectados entre sí. La estructura en la figura anterior es mucho más útil: vemos cómo los diferentes átomos están conectados entre sí para formar la molécula.
Estructuras Lewis Electron-Dot
En un capítulo anterior, aprendiste que los electrones de valencia de un átomo pueden mostrarse de manera sencilla con un diagrama de puntos electrónicos. Un átomo de hidrógeno se muestra como\(\ce{H} \cdot\) debido a su electrón de valencia. Las estructuras de las moléculas que se mantienen unidas por enlaces covalentes pueden ser esquematizadas por estructuras de puntos de electrones de Lewis. La molécula de hidrógeno se muestra en la siguiente figura.
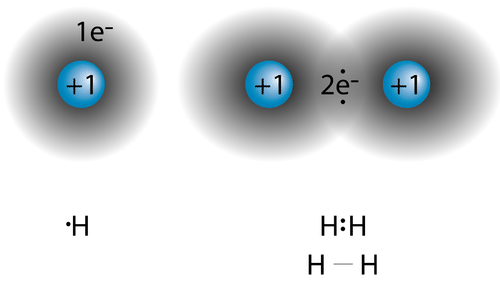
El par compartido de electrones se muestra como dos puntos entre los dos\(\ce{H}\) símbolos\(\left( \ce{H:H} \right)\). A esto se le llama un enlace covalente simple, cuando dos átomos se unen por la compartición de un par de electrones. El enlace covalente sencillo también se puede mostrar mediante un guion entre los dos símbolos\(\left( \ce{H-H} \right)\). Una fórmula estructural es una fórmula que muestra la disposición de los átomos en una molécula y representa enlaces covalentes entre átomos por guiones.
La regla del octeto y los enlaces covalentes
Cuando se forman iones, se ajustan a la regla del octeto ya sea perdiendo o ganando electrones para lograr la configuración electrónica del gas noble más cercano. De manera similar, los átomos no metálicos comparten electrones en la formación de un enlace covalente de tal manera que cada uno de los átomos involucrados en el enlace puede alcanzar una configuración de electrones de gas noble. Los electrones compartidos son “contados” para cada uno de los átomos involucrados en el intercambio. Para el hidrógeno\(\left( \ce{H_2} \right)\), el par compartido de electrones significa que cada uno de los átomos es capaz de alcanzar la configuración electrónica del helio, el gas noble con dos electrones. Para átomos distintos al hidrógeno, la compartición de electrones generalmente proporcionará a cada uno de los átomos ocho electrones de valencia.
Resumen
- Las estructuras de punto de electrones de Lewis muestran la unión en moléculas covalentes.
- Los enlaces covalentes entre átomos pueden indicarse ya sea con puntos\(\left( \ce{:} \right)\) o un guion\(\left( \ce{-} \right)\).
Revisar
- ¿Qué es un enlace covalente sencillo?
- ¿Cómo pueden los átomos unidos covalentemente obedecer la regla del octeto?
- ¿La molécula de hidrógeno obedece la regla del octeto?

