9.7: Múltiples enlaces covalentes
- Page ID
- 70405
¿Qué haces con tus sobras?
Cuando se trabaja con estructuras covalentes, a veces parece que hay electrones sobrantes. A lo mejor has aplicado las reglas que aprendiste hasta ahora, pero todavía hay algunos electrones colgando por ahí, desapegados. No puedes simplemente dejarlos ahí... Entonces, ¿dónde los pones?
Múltiples enlaces covalentes
Algunas moléculas no son capaces de satisfacer la regla del octeto haciendo solo enlaces covalentes simples entre los átomos. Considera el compuesto eteno, que tiene una fórmula molecular de\(\ce{C_2H_4}\). Los átomos de carbono están unidos entre sí, con cada carbono también unido a dos átomos de hidrógeno.
dos\(\ce{C}\) átomos electrones de\(= 2 \times 4 = 8\) valencia
electrones\(\ce{H}\) de\(= 4 \times 1 = 4\) valencia de cuatro átomos
= total de 12 electrones de valencia en la molécula
Si la estructura de punto electrónico de Lewis se dibujara con un enlace sencillo entre los átomos de carbono y con la regla del octeto seguida, se vería así:
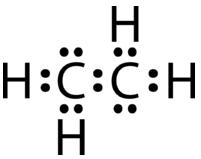
Esta estructura de Lewis es incorrecta porque contiene un total de 14 electrones. Sin embargo, la estructura de Lewis se puede cambiar eliminando los pares solitarios en los átomos de carbono y haciendo que los átomos de carbono compartan dos pares, en lugar de solo un par, de electrones.
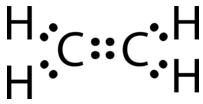
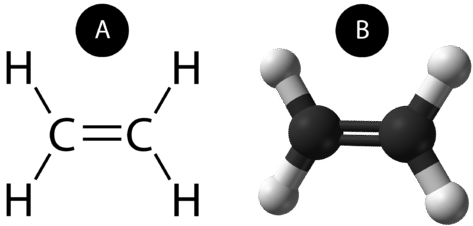
Un doble enlace covalente es un enlace covalente formado por átomos que comparten dos pares de electrones. El doble enlace covalente que se produce entre los dos átomos de carbono en etano también se puede representar por una fórmula estructural y con un modelo molecular, como se muestra en la siguiente figura.
Un triple enlace covalente es un enlace covalente formado por átomos que comparten tres pares de electrones. El elemento nitrógeno es un gas que compone la mayor parte de la atmósfera terrestre. Un átomo de nitrógeno tiene cinco electrones de valencia, los cuales pueden mostrarse como un par y tres electrones simples. Al combinarse con otro átomo de nitrógeno para formar una molécula diatómica, los tres electrones simples en cada átomo se combinan para formar tres pares compartidos de electrones.
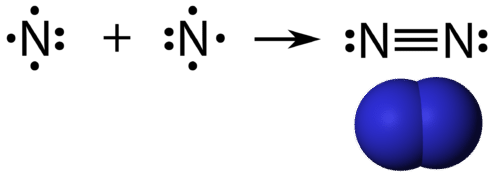
Cada átomo de nitrógeno sigue la regla del octeto con un par solitario de electrones, y seis electrones que se comparten entre los átomos.
Resumen
- Las estructuras de Lewis se pueden dibujar para moléculas que comparten múltiples pares de electrones.
- Un doble enlace covalente es un enlace covalente formado por átomos que comparten dos pares de electrones.
- Un triple enlace covalente es un enlace covalente formado por átomos que comparten tres pares de electrones.
Revisar
- ¿Por qué es incorrecta la primera estructura de Lewis de eteno?
- ¿Qué hacen los electrones simples en nitrógeno para formar un triple enlace?
- Dibuja la estructura de Lewis para el etino C 2 H 2.

