9.6: Enlaces Covalentes Individuales
- Page ID
- 70371
¿Qué mantiene unidas a las moléculas?
De una forma u otra, la idea de que los átomos se conecten para formar sustancias más grandes ha estado con nosotros desde hace mucho tiempo. El filósofo griego Demócrito (460-370 a.C.) creía que los átomos tenían ganchos que les permitían conectarse entre sí. Hoy en día, creemos que los átomos se mantienen unidos por enlaces formados cuando dos átomos comparten un conjunto de electrones, una imagen mucho más complicada que los simples ganchos en los que Demócrito creía.
Enlaces Covalentes Individuales
Se forma un enlace covalente cuando dos orbitales con un electrón se superponen entre sí. Para la molécula de hidrógeno, esto se puede mostrar como:
Al formarse la\(\ce{H_2}\) molécula, los electrones compartidos deben tener espín opuesto, por lo que se muestran con espín opuesto en el\(1s\) orbital atómico.
Los halógenos también forman enlaces covalentes simples en sus moléculas diatómicas. Un átomo de cualquier halógeno, como el flúor, tiene siete electrones de valencia. Su electrón desapareado se encuentra en la\(2p\) órbita.
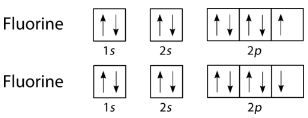
Los electrones simples en el tercer\(2p\) orbital se combinan para formar el enlace covalente:
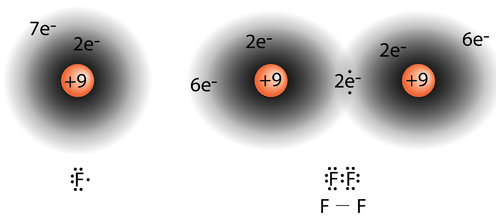
La molécula de flúor diatómica\(\left( \ce{F_2} \right)\) contiene un solo par compartido de electrones. Cada\(\ce{F}\) átomo también tiene tres pares de electrones que no se comparten con el otro átomo. Un par solitario es un par de electrones en una estructura electrón-punto de Lewis que no se comparte entre átomos. El átomo de oxígeno en la molécula de agua que se muestra a continuación tiene dos conjuntos de electrones de pares solitarios. Cada\(\ce{F}\) átomo tiene tres pares solitarios. Combinado con los dos electrones en el enlace covalente, cada\(\ce{F}\) átomo sigue la regla del octeto.
Ejemplo\(\PageIndex{1}\)
Dibuja la estructura de punto de electrones de Lewis para el agua.
Solución
Paso 1: Enumere las cantidades conocidas y planifique el problema.
Conocido
- Fórmula molecular del agua\(= \ce{H_2O}\)
- \(1 \: \ce{O}\)electrones de\(= 6\) valencia de átomos
- \(2 \: \ce{H}\)átomos\(=2 \times 1 = 2\) valencia electrones
- Número total de electrones de valencia\(=8\)
Utilice la tabla periódica para determinar el número de electrones de valencia para cada átomo y el número total de electrones de valencia. Organizar los átomos y distribuir los electrones para que cada átomo siga la regla del octeto. El átomo de oxígeno tendrá 8 electrones, mientras que los átomos de hidrógeno tendrán cada uno 2.
Paso 2: Resolver.
Los diagramas de puntos electrónicos para cada átomo son:
Cada átomo de hidrógeno con su electrón simple formará un enlace covalente con el átomo de oxígeno donde tiene un solo electrón. La estructura resultante de puntos de electrones de Lewis es:
Paso 3: Piensa en tu resultado.
El átomo de oxígeno sigue la regla del octeto con dos pares de electrones de enlace y dos pares solitarios. Cada átomo de hidrógeno sigue la regla del octeto con un par de electrones de enlace.
Resumen
- Los enlaces covalentes se forman cuando los electrones en dos átomos forman orbitales superpuestos.
- Los electrones de par solitario en un átomo no se comparten con ningún otro átomo.
Revisar
- ¿Cómo se forma un enlace covalente?
- ¿Qué relación tienen los giros de los electrones compartidos entre sí?
- ¿Los electrones de par solitario forman enlaces covalentes?

