9.10: Resonancia
- Page ID
- 70384
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
\( \newcommand{\dsum}{\displaystyle\sum\limits} \)
\( \newcommand{\dint}{\displaystyle\int\limits} \)
\( \newcommand{\dlim}{\displaystyle\lim\limits} \)
\( \newcommand{\id}{\mathrm{id}}\) \( \newcommand{\Span}{\mathrm{span}}\)
( \newcommand{\kernel}{\mathrm{null}\,}\) \( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\) \( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\) \( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\id}{\mathrm{id}}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\kernel}{\mathrm{null}\,}\)
\( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\)
\( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\)
\( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\) \( \newcommand{\AA}{\unicode[.8,0]{x212B}}\)
\( \newcommand{\vectorA}[1]{\vec{#1}} % arrow\)
\( \newcommand{\vectorAt}[1]{\vec{\text{#1}}} % arrow\)
\( \newcommand{\vectorB}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vectorC}[1]{\textbf{#1}} \)
\( \newcommand{\vectorD}[1]{\overrightarrow{#1}} \)
\( \newcommand{\vectorDt}[1]{\overrightarrow{\text{#1}}} \)
\( \newcommand{\vectE}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash{\mathbf {#1}}}} \)
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\(\newcommand{\longvect}{\overrightarrow}\)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
\(\newcommand{\avec}{\mathbf a}\) \(\newcommand{\bvec}{\mathbf b}\) \(\newcommand{\cvec}{\mathbf c}\) \(\newcommand{\dvec}{\mathbf d}\) \(\newcommand{\dtil}{\widetilde{\mathbf d}}\) \(\newcommand{\evec}{\mathbf e}\) \(\newcommand{\fvec}{\mathbf f}\) \(\newcommand{\nvec}{\mathbf n}\) \(\newcommand{\pvec}{\mathbf p}\) \(\newcommand{\qvec}{\mathbf q}\) \(\newcommand{\svec}{\mathbf s}\) \(\newcommand{\tvec}{\mathbf t}\) \(\newcommand{\uvec}{\mathbf u}\) \(\newcommand{\vvec}{\mathbf v}\) \(\newcommand{\wvec}{\mathbf w}\) \(\newcommand{\xvec}{\mathbf x}\) \(\newcommand{\yvec}{\mathbf y}\) \(\newcommand{\zvec}{\mathbf z}\) \(\newcommand{\rvec}{\mathbf r}\) \(\newcommand{\mvec}{\mathbf m}\) \(\newcommand{\zerovec}{\mathbf 0}\) \(\newcommand{\onevec}{\mathbf 1}\) \(\newcommand{\real}{\mathbb R}\) \(\newcommand{\twovec}[2]{\left[\begin{array}{r}#1 \\ #2 \end{array}\right]}\) \(\newcommand{\ctwovec}[2]{\left[\begin{array}{c}#1 \\ #2 \end{array}\right]}\) \(\newcommand{\threevec}[3]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \end{array}\right]}\) \(\newcommand{\cthreevec}[3]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \end{array}\right]}\) \(\newcommand{\fourvec}[4]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \\ #4 \end{array}\right]}\) \(\newcommand{\cfourvec}[4]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \\ #4 \end{array}\right]}\) \(\newcommand{\fivevec}[5]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \\ #4 \\ #5 \\ \end{array}\right]}\) \(\newcommand{\cfivevec}[5]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \\ #4 \\ #5 \\ \end{array}\right]}\) \(\newcommand{\mattwo}[4]{\left[\begin{array}{rr}#1 \amp #2 \\ #3 \amp #4 \\ \end{array}\right]}\) \(\newcommand{\laspan}[1]{\text{Span}\{#1\}}\) \(\newcommand{\bcal}{\cal B}\) \(\newcommand{\ccal}{\cal C}\) \(\newcommand{\scal}{\cal S}\) \(\newcommand{\wcal}{\cal W}\) \(\newcommand{\ecal}{\cal E}\) \(\newcommand{\coords}[2]{\left\{#1\right\}_{#2}}\) \(\newcommand{\gray}[1]{\color{gray}{#1}}\) \(\newcommand{\lgray}[1]{\color{lightgray}{#1}}\) \(\newcommand{\rank}{\operatorname{rank}}\) \(\newcommand{\row}{\text{Row}}\) \(\newcommand{\col}{\text{Col}}\) \(\renewcommand{\row}{\text{Row}}\) \(\newcommand{\nul}{\text{Nul}}\) \(\newcommand{\var}{\text{Var}}\) \(\newcommand{\corr}{\text{corr}}\) \(\newcommand{\len}[1]{\left|#1\right|}\) \(\newcommand{\bbar}{\overline{\bvec}}\) \(\newcommand{\bhat}{\widehat{\bvec}}\) \(\newcommand{\bperp}{\bvec^\perp}\) \(\newcommand{\xhat}{\widehat{\xvec}}\) \(\newcommand{\vhat}{\widehat{\vvec}}\) \(\newcommand{\uhat}{\widehat{\uvec}}\) \(\newcommand{\what}{\widehat{\wvec}}\) \(\newcommand{\Sighat}{\widehat{\Sigma}}\) \(\newcommand{\lt}{<}\) \(\newcommand{\gt}{>}\) \(\newcommand{\amp}{&}\) \(\definecolor{fillinmathshade}{gray}{0.9}\)¿Esto es un reflejo o una puerta?
Puedes mirar la imagen de abajo y pensar que estás mirando la imagen de una habitación como se refleja en un espejo (y probablemente lo estés). Pero la imagen puede recortarse de tal manera que dé la impresión de mirar la habitación real a través de una puerta. Verías lo mismo y recibirías la misma información, pero sería desde una perspectiva diferente. Hay moléculas que se pueden representar de diferentes maneras, de tal manera que la realidad se convierte en cuestión de interpretación.
Resonancia
Hay algunos casos en los que se puede dibujar más de una estructura de Lewis viable para una molécula. Un ejemplo es la\(\left( \ce{O_3} \right)\) molécula de ozono en la figura siguiente. Hay un total de 18 electrones en la estructura, por lo que son posibles las siguientes dos estructuras:
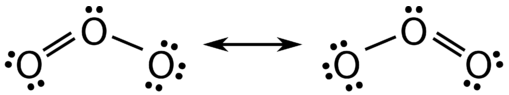
La estructura de la izquierda (ver figura anterior) se puede convertir a la estructura de la derecha mediante un desplazamiento de electrones sin alterar las posiciones de los átomos.
Alguna vez se pensó que la estructura de una molécula como\(\ce{O_3}\) consistía en un enlace sencillo y un doble enlace que luego se desplazaban hacia adelante y hacia atrás como se muestra anteriormente. Sin embargo, estudios posteriores mostraron que los dos enlaces son idénticos. Cualquier enlace covalente doble entre dos átomos dados es típicamente más corto que un enlace covalente simple. Los estudios de las moléculas\(\ce{O_3}\) y otras similares mostraron que los enlaces eran idénticos en longitud. Curiosamente, la longitud del enlace está entre las longitudes esperadas para un enlace\(\ce{O-O}\) sencillo y un doble enlace.
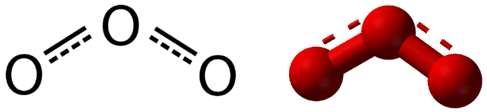
La resonancia es el uso de dos o más estructuras de Lewis para representar el enlace covalente en una molécula. Una de las estructuras válidas se conoce como una estructura de resonancia. Ahora se entiende que la verdadera estructura de una molécula que muestra resonancia es la de un promedio o un híbrido de todas las estructuras de resonancia. En el caso de la\(\ce{O_3}\) molécula, cada uno de los enlaces covalentes entre los\(\ce{O}\) átomos se considera mejor como enlaces “uno y medio”, a diferencia de un enlace sencillo puro o un doble enlace puro. Este “medio enlace” se puede mostrar como una línea punteada tanto en la estructura de Lewis como en el modelo molecular (ver figura a continuación).
Muchos iones poliatómicos también muestran resonancia. En algunos casos, la estructura verdadera puede ser un promedio de tres estructuras de resonancia válidas, como en el caso del ión nitrato,\(\ce{NO_3^-}\) (ver figura a continuación).
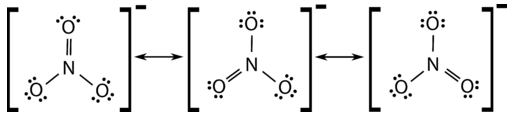
Las longitudes de enlace entre el\(\ce{N}\) átomo central y cada\(\ce{O}\) átomo son idénticas y los enlaces pueden aproximarse como iguales a enlaces de uno y un tercio.
Resumen
- Las estructuras de resonancia son promedios de diferentes posibilidades de estructura de Lewis.
- Las longitudes de los enlaces son intermedias entre los enlaces covalentes y los dobles enlaces covalentes.
Revisar
- ¿Cuántos electrones totales hay en la estructura del ozono?
- ¿Qué cambia en las dos estructuras de resonancia del ozono?
- ¿Cómo podemos pensar en los enlaces covalentes en el ozono?


