9.11: Excepciones a la Regla del Octeto
- Page ID
- 70376
¿Siempre se siguen las reglas?
Cada primavera, millones de estadounidenses presentan sus formularios de impuestos sobre la renta. Las diferentes reglas determinan cuánto impuesto paga una persona. También hay excepciones a las reglas. Pagas menos impuestos si estás casado y/o tienes hijos. Hay ciertos límites en cuanto a la cantidad de dinero que puedes ganar antes de pagar impuestos. La regla es que pagues impuestos, pero también hay excepciones en función de tu situación personal. Las reglas de unión para moléculas son generalmente aplicables, pero hay algunas excepciones permitidas.
Excepciones a la Regla del Octeto
Como dice el refrán, todas las reglas están hechas para romperse. Cuando se trata de la regla del octeto, esto es cierto. Las excepciones a la regla del octeto se clasifican en una de tres categorías: (1) un octeto incompleto, (2) moléculas de electrones impares y (3) un octeto expandido.
Octeto incompleto
En algunos compuestos, el número de electrones que rodean al átomo central en una molécula estable es inferior a ocho. El berilio es un metal alcalinotérreo y por lo tanto se puede esperar que forme enlaces iónicos. Sin embargo, su tamaño muy pequeño y una energía de ionización algo mayor en comparación con otros metales en realidad lleva al berilio a formar compuestos principalmente moleculares. Dado que el berilio solo tiene dos electrones de valencia, normalmente no alcanza un octeto a través del intercambio de electrones. La estructura de Lewis del hidruro de berilio gaseoso\(\left( \ce{BeH_2} \right)\) consiste en dos enlaces covalentes simples entre\(\ce{Be}\) y\(\ce{H}\) (ver figura abajo).
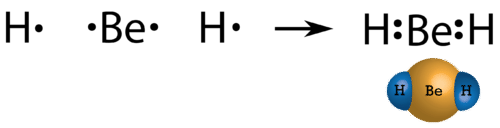
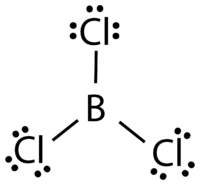
El boro y el aluminio, con tres electrones de valencia, también tienden a formar compuestos covalentes con un octeto incompleto. El átomo central de boro en el tricloruro de boro\(\left( \ce{BCl_3} \right)\) tiene seis electrones de valencia, como se muestra en la siguiente figura.
Moléculas de electrones impares
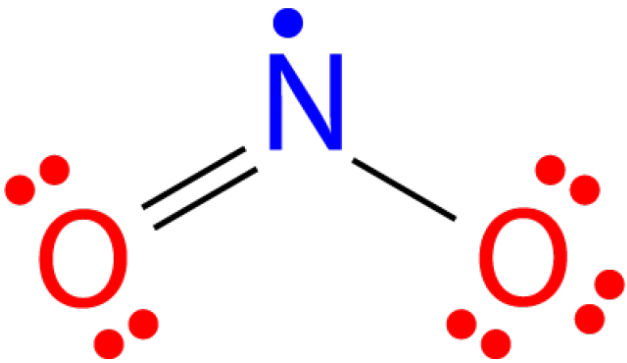
Hay una serie de moléculas cuyo número total de electrones de valencia es un número impar. No es posible que todos los átomos en tal molécula satisfagan la regla del octeto. Un ejemplo es el dióxido de nitrógeno\(\left( \ce{NO_2} \right)\). Cada átomo de oxígeno aporta seis electrones de valencia y el átomo de nitrógeno aporta cinco para un total de diecisiete. La estructura de Lewis para\(\ce{NO_2}\) aparece en la siguiente figura.
Octetos Ampliados
Los átomos del segundo periodo no pueden tener más de ocho electrones de valencia alrededor del átomo central. Sin embargo, los átomos del tercer período y más allá son capaces de exceder la regla del octeto al tener más de ocho electrones alrededor del átomo central. A partir del tercer periodo, el\(d\) subnivel se vuelve disponible, por lo que es posible utilizar estos orbitales en la unión, dando como resultado un octeto expandido.
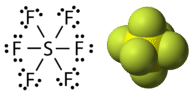
El fósforo y el azufre son dos elementos que reaccionan con elementos halógenos y hacen compuestos estables con octetos expandidos. En el pentacloruro de fósforo, el átomo central de fósforo forma cinco enlaces simples a los átomos de cloro y, como resultado, tiene diez electrones rodeándolo (ver figura abajo). En el hexafluoruro de azufre, el átomo central de azufre tiene doce electrones desde sus seis enlaces hasta átomos de flúor (ver figura a continuación).
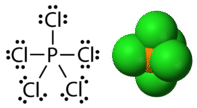
Resumen
- Existen excepciones a las reglas para el enlace covalente
- Estas excepciones se aplican a los átomos cuyos electrones no acomodarán la regla normal del octeto.
Revisar
- ¿Qué es un octeto incompleto?
- ¿Qué es una molécula de electrones impares?
- ¿Por qué hay electrones adicionales en el octeto expandido?

